Класификация и номенклатура на дизахаридите
Въглехидрати
Въглехидрати (или старо име захар) - полихидроксикарбонилни съединения и техните производни от естествен произход.
1) монозахариди,
2) олигозахариди,
1. монозахариди
Монозахариди (или монози) Полихидроксикарбонилни съединения и техните производни непрекъсната въглеродна верига.
Монозахаридните молекули са хирални, съдържат няколко асиметрични въглеродни атома.
В зависимост от естеството на карбонилната група:
В зависимост от броя на въглеродните атоми в молекулата (3 до 10) монозахаридите се подразделят на триози, тетрози, пентози, хексози, хептози и др. Например:

тетроза пентоза хексоза
Изомеризъм, номенклатура
Структурни и оптични видове изомерия.
Единствената молекула алдотриоза, глицералдехид, има един хирален въглероден атом, така че са възможни само два енантиомера.
д-глицералдехид, L-глицералдехид
Относителната конфигурация на всеки от монозахаридите се определя от конфигурационния стандарт - глицералдехид. Възлагане на д- или L-ред, определен от конфигурацията най-отдалеченото от карбонилната група на хирален въглероден атом. На всяка алдоза д-серия съответства на енантиомера (вещество L-ред) с противоположна конфигурация от всички центрове на хиралност.
д-арабиноза L-арабиноза д-ликсоза L-ликсоза,


От кетозата фруктозата и сорбозата са най-широко разпространени:
д-фруктоза L-фруктоза д-сорбоза L-сорбоза
Извикват се диастереомери, които се различават по конфигурацията само на един асиметричен въглероден атом епимери. Епимери - специален случай на диастереомери.
Образуване на циклични полуацетали.
Например за д-рибоза:

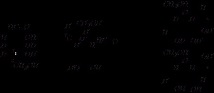
Нарича се и полуацеталната хидроксилна група в въглехидратната химия гликозидни.
За изобразяване на циклични форми на монозахариди се приемат перспективни (пространствени) формули, предложени от W. Hewors * през 1926 г. (както е показано на диаграмата).
Когато се конструират формулите на Хюорт, цикълът обикновено се счита за плосък, докато частта от пръстена, която е най-близо до наблюдателя, обикновено се подчертава с по-дебела линия. Кислородният атом от цикъла се намира на най-голямо разстояние от наблюдателя. Атомите и групите атоми, изобразени във формулите на Фишер вляво и вдясно, във формулите на Хюорс, са разположени съответно над и под равнината на цикъла. Страничните вериги, съдържащи въглеродни атоми, които не са включени в цикъла в алдози, са изобразени над равнината за д-изомери и под равнината за L-изомери (с атоми С4 при алдопентози и С5 при алдохексози).
Циклично образуване на полуацетал е пример циклооксотавтомерия или пръстен-верига тавтомеризъм.
Възможно съществуване пираноза (шестчленен) и фураноза (петчленни) циклични форми.
Аномери (a-аномер и b-аномер) са специален случай на епимери. Принадлежността към a- или b-формата се определя от конфигурацията на аномерния въглероден атом (за алдозите това е С1, за кетоза това обикновено е, С2). В молекулата на а-аномера относителните конфигурации на аномерния въглероден атом и последния асиметричен атом във въглеродната верига съвпадат. В молекулата на b-аномера, напротив, те не съвпадат.

Пълното наименование на монозахарида включва обозначението на конфигурацията на аномерния въглероден атом (a- или b-) и размера на пръстена (пираноза или фураноза). Например:
За кетозата образуването на циклични форми се случва подобно на алдозите.
В твърдо състояние всички монозахариди са предимно в пиранозна форма, като най-стабилната от възможните циклични форми. Различни аномери (a- и b-) д-глюкозата се различават в специфичното въртене: за a-аномер ¾ + 112 °, за b-аномер ¾ + 19 °.
В разтвори се образува равновесна смес от всички циклични форми и оксоформи. За водни разтвори д-глюкоза този ъгъл е + 52,5 °. Това се дължи на аномеризация, тези. взаимно превръщане на a- и b-аномери един в друг чрез междинната оксо форма и установяването на тавтомерно равновесие.
Нарича се промяната в ъгъла на въртене на равнината на поляризирана светлина, свързана с това явление мутаротация.
Химични свойства
1) влизат в реакции с участието на оксогрупата,
2) показват свойствата на хемиацетали,
3) свойствата на многоатомните алкохоли (например те дават качествена реакция на многоатомните алкохоли - взаимодействие с Cu (OH) 2 с образуването на стабилни комплекси).
- Класификация на марки климатици със сплит система
- Класификация на хотели по "звезди"
- Класиране и класиране на зърнени материали, страница 8
- Класификация на нещата в римското право, Синопсис на адвоката
- Класификация на кораби, транспортни кораби, полезни кораби, кораби от техническия флот и