Определяне на съотношението на топлинните мощности на въздуха, Учител, Учител
ОБОРУДВАНЕ: инсталация, състояща се от стъклен цилиндър, манометър, компресор, хронометър.
Топлинен капацитет на веществото се нарича физическа величина, числено равна на количеството топлина, което трябва да му бъде съобщено, за да се повиши температурата на веществото с един келвин.
Топлинният капацитет на единица маса се нарича специфична топлина, а топлинният капацитет на един мол вещество се нарича моларен топлинен капацитет.
където с и С - специфичен и моларен топлинен капацитет,
- топлина, подавана към системата,
dT - промяна на температурата,
m - обща маса на материята,
- неговото молекулно тегло.
Топлинният капацитет за едно и също вещество зависи както от състоянието на агрегация, така и от условията на нагряването му.
Нагряването на веществото може да се случи както при постоянно налягане, така и при постоянен обем. Помислете за тези процеси.
а) P = const. Изобарен процес.
Първият закон на термодинамиката за един изобарен процес е:
промяна във вътрешната енергия на идеален газ:
Елементарна работа с равновесна промяна в обема, изчислена от уравнението на състоянието на газа:
От изрази (1.1), (1.2), (1.3), (1.4) получаваме за моларната топлинна мощност при постоянно налягане:
където: i е броят на градусите на свобода на газовите молекули е броят на независимите координати, които определят положението на молекулата в пространството: i = 3 за едноатомна, i = 5 за двуатомна, i = 6 за три- и многоатомни;
R = 8,31 J/mol. R - универсална газова константа.
б) V = const. Изохорен процес.
Първият закон на термодинамиката за изохорния процес
тези. цялата доставена топлина отива само за промяна на вътрешната енергия на системата. Като вземем предвид изразите (1.1) и (1.3), имаме
по този начин топлинният капацитет на идеалния газ зависи само от вида на газа (i) и от вида на процеса.
в) В инженерството, когато се анализират топлинни процеси и цикли, като правило няма нужда да се изчислява или експериментално да се определя отделно топлинният капацитет при постоянно налягане Cp и при постоянен обем Cv. Тяхното изчисляване и измерване е свързано с определени трудности (многокомпонентен газ, незначителна маса газ в сравнение с съд, който го съдържа и др.).
В много случаи е достатъчно да се знае само връзката им:
където - се нарича адиабатен показател или съотношение на Поасон.
Адиабатичният е процес, който протича без топлообмен с околната среда.
От 1 началото на термодинамиката за адиабатен процес следва:
тези. разширяващият се газ работи срещу външни сили, като намалява вътрешната си енергия.
В израз (2.7) работата се изразява чрез промяна на температурата и тъй като налягането се измерва в експеримента, ние ще променим параметрите.
От уравнението на състоянието заместваме в уравнение (2.7)
Като се има предвид, че и от израза (2.3), следва:
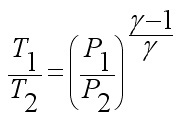
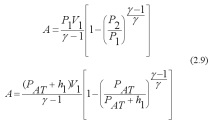
ОПИСАНИЕ НА МОНТАЖА И МЕТОД ЗА ИЗМЕРВАНИЯ
Методът, предложен от Klepan и Desorm (1819), се основава на изследването на параметрите на определена маса газ, преминаваща от едно състояние в друго чрез два последователни процеса: адиабатен и изохорен.
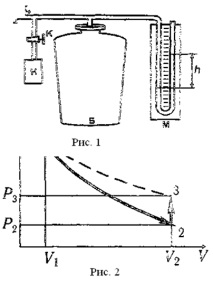
Тези процеси на диаграмата P-V (фиг. 1) са представени съответно с криви 1-2 и 2-3. Ако изпомпате въздух в цилиндър и го задържите, докато се установи топлинно равновесие с околната среда, тогава в това начално състояние 1 газът има параметри P1, V1, T1, а температурата на газа в цилиндъра е равна на температурата на околната среда и налягане P1 = P0 + P 'е малко по-високо от атмосферното P0.
Когато клапанът K0 се отвори, въздухът в цилиндъра ще влезе в състояние 2. Налягането му ще спадне до атмосферно P2 = P0. Останалата въздушна маса, която в състоянието заемаше 1 част от обема на цилиндъра, разширявайки се, ще заеме целия обем на V2. В този случай температурата на въздуха, останал в цилиндъра, ще намалее. С бързото разширяване на газа неговият топлообмен с околната среда през стените на цилиндъра може да бъде пренебрегнат и процесът 1-2 може да се счита за адиабатичен:
След затваряне на клапана Ko, въздухът в цилиндъра, охладен чрез адиабатно разширение, ще се нагрее (процес 2-3) до околната температура T3 = T1 с постоянен обем V2 = V3 В същото време налягането в цилиндъра ще се увеличи до P3 = P2 + P "
Излишното въздушно налягане P 'и P' 'се измерва с помощта на U-образен манометър според разликата в нивата на течността с плътност p:
където H и h са показанията на манометъра съответно в състояния 1 и 3.
Тогава
Въздушните състояния 1 и 3 принадлежат към изотермата, следователно:
Елиминирайки съотношението на обемите от уравнения (7) и (9), намираме връзката на налягането на газа:
Нека изразим наляганията P1 и P2 до P0, като вземем предвид (8.8) към логаритъма:
Като се има предвид, че ако x С нарастването на времето за разширяване на газа стойността на h ’намалява, приближавайки се до нула при t → ∞ (изотермично разширение 1-3), експериментално е установено, че
Като вземем логаритъма на тази функция, получаваме зависимостта
където a е инсталационната константа,
t е времето на процеса, през което балонът е в комуникация с атмосферата. Графиката на зависимостта (11) на крайното излишно въздушно налягане в цилиндъра от времето на контакта му с атмосферата е показана на фиг. 3.
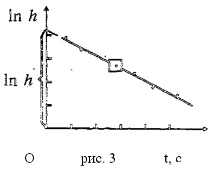
След изграждането на такава графика въз основа на експерименталните данни е възможно чрез екстраполиране на експерименталната права линия до t = 0 да се определи стойността на In h и от нея стойността на h, необходима за изчисляване по формулата (10).
тестови въпроси
1. Какво се нарича: а) топлинната способност на тялото; б) специфичен топлинен капацитет на газа; в) моларният топлинен капацитет на газа? В какви единици се измерват?
2. Какво определя тези топлинни мощности?
3. Какви са моларните топлинни мощности Cp и Cv за въздух? Какво обяснява, че Cp> Cv?
4. За кои топлинни мощности са съотношенията Cp = C v + R ?
5. Какво се нарича броят на градусите на свобода на молекулата?
6. Какви са стойностите на адиабатния показател а) за двуатомен; б) за триатомен и многоатомен идеален газ?
7. За кой газ: едноатомен смърч двуатомен - адиабатната графика е по-стръмна?
8. Запишете първия закон на термодинамиката за адиабатния процес.
9. Какви процеси се описват от уравненията: PV = const;
10. Как се променят температурата и налягането на газа: а) адиабатно
разширяване; б) с адиабатна компресия?
11. В какви състояния от посочените на диаграмата (фиг. 2, стр. 89) въздухът в цилиндъра: а) има стайна температура; б) е при атмосферно налягане?
12. Какъв процес се извършва при отваряне на клапана К2, ако в цилиндъра е имало излишно налягане на въздуха?
13. Какъв процес се случва след адиабатното разширение на газа по време на експеримента?
14. Какви величини се измерват в работата за изчисляване на адиабатния показател ?
15. По каква формула се определя стойността на съотношението на топлинните мощности а) експериментална; б) теоретична?
- Определяне на топлинния капацитет на въздуха
- ОПРЕДЕЛЯНЕ НА ТОПЛИННИЯ КАПАЦИТЕТ НА ВЪЗДУХА
- Определяне на съотношението на специфичните топлинни мощности на въздуха
- Определяне на скоростта на въздуха (кататермометрия), безплатни курсови, реферати и дисертации
- Математически модел за определяне на пространствени координати чрез пасивен радар - тема