Определяне на съотношението на специфичните топлинни мощности на въздуха
Устройства и аксесоари: стъклена бутилка, помпа, хронометър,
Кратка теория
Законите на идеалните газове
При изследването на процесите в газовете се въвежда понятието идеален газ. Газът се счита за идеален, ако са изпълнени следните условия:
1. Размерите на газовите молекули са незначителни.
2. Няма сили на взаимодействие между молекулите,
3. Сблъсъците на молекули са еластични.
Състоянието на идеалния газ се характеризира с три термодинамични параметъра: налягане R, сила на звука V, температура т.
Извиква се преходът на газ от едно състояние в друго, придружен от промяна в неговите параметри процес.
Ако един от параметрите остане постоянен, тогава процесът се нарича изопроцес. Нека разгледаме някои изопроцеси.
Изотермичен процес
Изотермичният процес е процес, който протича при постоянна температура, т= const. Другите два параметъра се променят. Изотермичният процес е описан от уравнението:
PV = const - закон на Бойл-Марио, (1)
който гласи: дЗа дадена маса газ при постоянна температура произведението на налягането на газа и неговия обем е постоянна стойност.
Изохорен процес
Изохорният процес протича при постоянен обем. Зависимостта на налягането от температурата се описва от уравнението:
- Законът на Чарлз, (2)
който гласи: за дадена маса газ при постоянен обем налягането на газа нараства линейно с повишаване на температурата.
Изобарен процес
Изобарен процес. Това е процес, който протича при постоянен натиск., R= const.
Зависимостта на обема от температурата е описана от закона:
- Законът на Гей-Лусак, (3)
който гласи: за дадена маса газ при постоянно налягане, обемът на газа се увеличава линейно с увеличаване на температурата.
Адиабатен процес
Адиабатичният процес е процес, който протича без топлообмен с околната среда (dQ = 0). Описано е от уравнението на Поасон:
където g е константата на адиабатния процес. Константата на адиабатния процес е:
. (пет)
При адиабатичен процес всички параметри на газа се променят: налягане, обем и температура.
Топлинен капацитет на газ
Количество топлина dQ,съобщава на тялото при нагряване е
,
Където с - специфична топлина на дадено вещество, равно на количеството топлина, придавано на единица маса на веществото, за да се нагрее с една степен.
В допълнение към специфичния топлинен капацитет се въвежда понятието моларен топлинен капацитет. Моларен топлинен капацитет С - равно на количеството топлина, предадено на един мол вещество, за да се нагрее с една степен.
Моларният и специфичният топлинен капацитет са свързани със съотношението:
Където С-моларен топлинен капацитет, m-моларна маса.
Газът може да се нагрява при постоянно налягане и при постоянен обем; следователно за газа се въвеждат два топлинни капацитета: изобарен и изохорен. Моларният изобарен и моларният изохорен топлинен капацитет на газа са свързани със съответните съотношения:
; .
Следователно може да се види, че съотношението на моларните топлинни мощности на газа е равно на съотношението на специфичния .
Количеството топлина, предадено на 1 мол газ в изохорния процес, е:
, (7)
и в изобарен процес
. (8)
Първият закон на термодинамиката
Количество топлина dQ, докладван на термодинамичната система се изразходва за увеличаване на нейната вътрешна енергия dU и да работи dA системи срещу външни сили.
Вътрешна енергия U- общата енергия на всички молекули в газа за идеален газ - кинетичната енергия на въртеливо и транслационно движение. За един мол газ се определя от израза
. (десет)
Работата, извършена от газа е
Където dV - промяна в обема му.
Приложение на първия закон на термодинамиката
Изотермичен процес
По време на този процес температурата остава постоянна (т= const) IN този случай dT= 0 и вътрешната енергия не се променя dU= 0 dQ = dA, тези. цялата доставена топлина се изразходва от газа за извършване на работа срещу външни сили.
Изохорен процес
С изохорен процес V= const, dV= 0 и dA= 0. Тези. в този процес работата не се извършва, тъй като силата на звука не се променя. След това 1 започна да записва:
Тези. количеството топлина се изразходва за промяна на вътрешната енергия. Но по дефиниция (за 1 мол). Следователно, .
От тази формула може да се види, че промяната във вътрешната енергия на газа се определя само от промяната в неговата температура. Топлинният капацитет при постоянен обем (изохорен топлинен капацитет) е равен на:
(12)
Изобарен процес
В този процес се променят както вътрешната енергия, така и работата срещу външните сили:
тези. топлината, подавана към системата, се използва за увеличаване на вътрешната енергия и за извършване на работа срещу външни сили.
За 1 мол газ, уравнението на Менделеев - Клапейрон
но pdV = dA, така dA = RdT, тогава
(Спомнете си това Cu и Cp - моларен топлинен капацитет)
R - универсална газова константа, равна на работата на разширяване на един мол газ при нагряване с една степен в изобарен процес.
Уравнение (13) се нарича уравнение на Робърт Майер. От това следва: при изобарно нагряване на 1 мол газ на 1 0 част от топлината, равно на CV, отива за увеличаване на вътрешната енергия, а другата част, равна R, -да вършат работа срещу външни сили.
Адиабатен процес
Тъй като в адиабатния процес dQ= 0, тогава dA = –dU. Първият закон на термодинамиката ще бъде
От което следва, че в адиабатен процес се извършва работа поради промяна във вътрешната енергия.
Например, ако отворите зърното на колелото на автомобила, тогава отработеният въздух може да се счита за адиабатно разширение. Работата по разширяване на въздуха се осъществява чрез намаляване на вътрешната енергия, което ще доведе до охлаждане на въздуха и зърното ще стане студено.
Степени на свобода
Според молекулярно-кинетичната теория вътрешната енергия, която се дължи на движението на молекулите, както транслационна, така и ротационна, се определя от (10), където i- брой степени на свобода.
Броят на степени на свобода iе броят на независимите координати, които напълно определят позицията на молекулата в пространството.
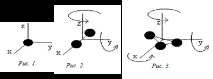
В случай на твърда връзка, например:
един. Моноатомната молекула има само три степени на свобода на транслационното движение, i= 3 (въртеливото движение не се взема предвид за атом като материална точка); (Фиг. 1).
2. Диатомната молекула има три степени на свобода на транслационно движение и две степени на свобода на въртеливо движение, i= 5 (фиг. 2);
3. Триатомната молекула има три степени на свобода на транслационно движение и три степени на свобода на въртеливо движение; i= 6 (фиг. 3).
От (10), (11) и (12) е възможно да се изчисли вътрешната енергийна и топлинна мощност на газа и от формула (1) да се определи адиабатната константа g.
1. За едноатомен газ i= 3
;
;
.
Адиабатна константа .
2. За двуатомен газ i= 5 и подобно на предишния получаваме
3. За триатомен газ i= 6
;
; .
- Определяне на топлинния капацитет на въздуха
- ОПРЕДЕЛЯНЕ НА ТОПЛИННИЯ КАПАЦИТЕТ НА ВЪЗДУХА
- Определяне на съотношението на топлинните мощности на въздуха, Учител, Учител
- Определяне на скоростта на въздуха (кататермометрия), безплатни курсови, реферати и дисертации
- Математически модел за определяне на пространствени координати чрез пасивен радар - тема