Мускулна биохимия
Вътрешното съдържание на симпласта е саркоплазма Е колоидна протеинова структура (наподобява желе по консистенция). В суспендирано състояние той съдържа гликогенови включвания, мастни капчици, различни подкласове са вградени в него.фини частици: ядра, митохондрии, миофибрили, рибозоми и други.
Съкратителният "механизъм" вътре в симпласта - миофибрили. Това са тънки (Ø 1 - 2 микрона) мускулни нишки, дълги - почти равни на дължината на мускулното влакно. Установено е, че в симпластите на нетренирани мускули миофибрилите са разположени неправилно, по протежение на симпласта, но с разсейване и отклонения, а в тренираните мускули миофибрилите са ориентирани по надлъжната ос и също са групирани в снопове като при въжетата. (При предене на изкуствени и синтетични влакна, полимерните макромолекули първоначално не са разположени строго по влакното и, подобно на спортистите, те са „упорито тренирани“ - ориентирани правилно - по оста на влакната, чрез многократно пренавиване: вижте дълги семинари в ZIV и Khimvolokno ).
В светлинен микроскоп може да се забележи, че миофибрилите наистина са "кръстосани". Те редуват светли и тъмни области - дискове. Тъмни дискове И (анизотропни) протеини съдържат повече от леки дискове Аз (изотропен). Леките дискове са кръстосани от мембрани Z. (телофрагми) и областта на миофибрилата между две Z.-мембрани наречени саркомер. Myofibril се състои от 1000 - 1200 саркомера (фиг. 5).
Контракцията на мускулното влакно като цяло се състои от контракциите на единични саркомери. Договаряйки всеки поотделно, саркомерите колективно създават интегрална сила и извършват механична работа за свиване на мускула.
Зана саркомер варира от 1,8 µm в покой до 1,5 µm с умерено и до 1 µm с пълно свиване. Дисковете от саркомери, тъмни и светли, съдържат протофибрили (миофиламенти) - протеинови нишковидни структури. Те са два вида: дебели (Ø - 11 - 14 nm, дължина - 1500 nm) и тънки (Ø - 4 - 6 nm, дължина - 1000 nm).
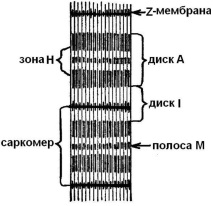
Фигура: 5. Място на миофибрила.
Леки дискове (Аз) се състоят само от тънки протофибрили и тъмни дискове (И) - от протофибрили от два вида: тънки, закрепени заедно с мембрана и дебели, концентрирани в отделна зона (З.).
Когато саркомерът се свие, дължината на тъмния диск (И) не се променя и дължината на светлинния диск (Аз) намалява, тъй като тънките протофибрили (светли дискове) се избутват в пространствата между дебели (тъмни дискове). На повърхността на протофибрилите има специални израстъци - сраствания (с дебелина около 3 nm). В „работно положение“ те образуват ангажимент (чрез напречни мостове) между дебели и тънки нишки от протофибрили (фиг. 6). При намаляване Z.-мембраните почиват на дебелите краищатофибрили, а тънките протофибрили дори могат да увиват дебели. При суперконтракция краищата на тънки нишки в центъра на саркомера се увиват, а краищата на дебели протофибрили се мачкат.
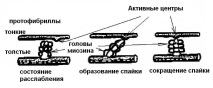
Фигура: 6. Образуване на адхезия между актин и миозин.
Захранването с енергия на мускулните влакна се извършва с помощта саркоплазмен ретикулум (тя - саркоплазмен ретикулум) - системи на надлъжна и папаречни тръби, мембрани, мехурчета, отделения.
В саркоплазмения ретикулум различни биохимични процеси протичат организирано и контролирано, мрежата обхваща всичко заедно и всяка миофибрила поотделно. Ретикулумът включва рибозоми, те осъществяват синтеза на протеини, а митохондриите са „клетъчни енергийни станции“ (както е определено в училищния учебник). Всъщност митохондрии вградени между миофибрилите, което създава оптимални условия за енергийно снабдяване на мускулния процес на свиване. Установено е, че броят на митохондриите в тренираните мускули е по-голям, отколкото в същите нетренирани.
Мускулна химия.
Поливайте составя 70 - 80% от мускулното тегло.
Протеин. Протеините представляват 17 до 21% от мускулното тегло: приблизително 40% от всички мускулни протеини са концентрирани в миофибрилите, 30% в саркоплазмата, 14% в митохондриите, 15% в сарколемата, останалото в ядрата и други клетъчни органиНела.
Без азот връзки. Мускулите съдържат въглехидрати, гликоген и метаболитните му продукти, както и мазнини, холестерол, кетонни тела и минерални соли. В зависимостКоличеството гликоген варира от 0,2 до 3% в зависимост от диетата и степента на фитнес, докато тренировките увеличават масата на свободния гликоген. Резервните мазнини в мускулите се натрупват по време на тренировка за издръжливост. Свързаната с протеини мазнина е приблизително 1% и в мембраните на мускулните влакна можеподдържайте до 0,2% холестерол.
Минерали. Минералните вещества на мускулната тъкан съставляват около 1 - 1,5% от мускулното тегло, това са предимно соли на калий, натрий, калций, магнезий. Минерални йони като K +, Na +, Mg 2+, Ca 2+, Cl -, HP04
играят важна роля в биохимичните процеси по време на мускулна контракция (те са включени в състава на „спортните“ добавки и минералната вода).
Биохимия на мускулните протеини.
Основният контрактилен протеин на мускулите - миозин се отнася до фибриларни протеини (молекулно тегло около 470000). Важна характеристика на миозина е способността да образува комплекси с молекули АТФ и АДФ (което ви позволява да „взимате“ енергия от АТФ), а с протеин - актин (което прави възможно запазването на контракцията).
Молекулата на миозина има отрицателен заряд и специфично взаимодейства с йони Ca ++ и Mg ++. Миозинът в присъствието на Ca ++ йони ускорява хидролизата на АТФ и по този начин проявява ензим активност на аденозин трифосфат:
миозин-АТФ + H2O → миозин + ADP + H3PO4 + Работа (енергия 40 kJ/mol)
Миозиновият протеин се образува от две еднакви, дълги полипептидни α-вериги, усукани като двойна спирала, Фиг. 7. Под действието на протеолитичен ферМолекулата на миозина се разделя на две части. Една от неговите части е в състояние да се свърже чрез сраствания с актин, образувайки актомиозин. Тази част е отговорна за активността на аденозин трифосфатазата, която зависи от рН на средата, оптималното е рН 6,0 - 9,5, както и концентрацията на KCl. Актомиозиновият комплекс се разлага в присъствието на АТФ, но при липса на свободен АТФ е стабилен. Втората част на молекулата на миозина също се състои от две усукани спирали, поради електростатичния заряд те свързват молекулите на миозин в протофибрили.
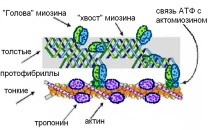
Фигура: 7. Структура на актомиозин.
Вторият по важност контрактилен протеин е актин (фиг. 7). Той може да съществувада се образува в три форми: мономерна (кълбовидна), димерна (кълбовиднабуларен) и полимерен (фибриларен). Мономерен кълбовиденНовият актин, когато неговите полипептидни вериги са плътно опаковани в компактна сферична структура, се свързва с АТФ. Чрез разцепване на АТФ, актиновите мономери - А, образуват димери, включително ADP: A - ADP - A. Полимерният фибриларен актин е двойна спирала, състояща се от димери, Фиг. 7.
Кълбовидният актин се превръща във фибриларен в присъствието на йони K +, Mg ++, а фибриларният актин преобладава в живите мускули.
Миофибрилите съдържат значително количество протеин тропомиозин, които ссе състои от две - α-спиралови полипептидни вериги. В почиващи мускули той образува комплекс с актин и блокира активните му центрове, тъй като актинът е в състояние да се свърже с Ca ++ йони и те премахват тази блокада.
На молекулярно ниво дебелите и тънки протофибрили на саркомера взаимодействат електростатично, тъй като те имат специални области - израстъци и издатини, където се образува зарядът. В областта на A-диска дебелите протофибрили са изградени от сноп от надлъжно ориентирани молекули на миозин, тънки протофибрили са разположени радиално около дебели, образувайки структура, подобна на многожилен кабел. В централната М-лента от дебели протофибрили, миозинnena с техните "опашки" и изпъкналите им "глави" - израстъците са насочени в различни посоки и са разположени вдясновъртящи се спирални линии. Всъщност, обратно на тях, мономерните актинови глобули също са вградени в спиралите на фибриларния актин на определено разстояние една от друга. Всеки перваз има активен център, поради което е възможноно образуването на сраствания с миозин. Z-мембраните на саркомерите (като редуващи се цокли) поддържат тона заеднокоито протофибрили.
Биохимията на свиване и релаксация.
Цикличните биохимични реакции, възникващи в мускула по време на свиване, осигуряват повтарящ се моделобразуване и унищожаване на сраствания между "главите" - израстъци на мол миозинкул от дебели протофибрили и издатини - активни центрове на тънки протофибрили. Работата по образуването на сраствания и напредването на актиновата нишка по миозиновата нишка изисква както прецизен контрол, така и значителна консумация на енергия. Наистина в моментаразделянето на влакната се образува около 300 сраствания в минута във всеки активен център - издатината.
Както отбелязахме по-рано, само АТФ енергията може директно да се преобразува в механична работа на мускулната контракция. АТФ, хидролизиран от ензимния център на миозина, образува комплекс с целия протеин миозин. В АТФ-миозиновия комплекс миозинът, наситен с енергия, променя структурата си, а заедно с това и външните „измерения“ и по този начин извършва механична работа за скъсяване на израстването на миозиновата нишка.
В мускулите в покой миозинът все още е свързан с АТФ, но чрез йони Mg ++ без хидролитично разцепване на АТФ. Образуването на сраствания между миозин и актин в покой се предотвратява от комплекса тропомиозин-тропонин, който блокира активните центрове на актина. Блокадата се провежда и АТФ не се разцепва, докато са свързани йоните на Са ++. Когато нервният импулс пристигне в мускулното влакно, неимпулсен предавател - неврохормон ацетилхолин. Йони Na + отрицателнизарядът на вътрешната повърхност на сарколемата се неутрализира и настъпва неговата деполяризация. В този случай се освобождават йони Ca ++ и се свързват с тропонин. На свой ред тропонинът губи своя заряд, поради което активните центрове - издатини на актинови нишки се отблокират иима сраствания между актин и миозин (тъй като електростатичното отблъскване на тънки и дебеливече са премахнати протофибрилите). Сега, в присъствието на Са ++, АТФ взаимодейства с центъра на ензимаактивността на миозина и се разцепва, а енергията на трансформиращия комплекс се използва за намаляване на адхезията. Описаната по-горе верига от молекулярни събития е подобна на електрически ток, презареждащ микрокондензатор, електрическата му енергия веднага се преобразува в механична работа на място и трябва да се презареди отново (ако искате да продължите).
След разкъсването на адхезията, АТФ не се разцепва, а отново образува ферментов-субстратен комплекс с миозин:
M - A + ATP -----> M - ATP + A или
M - ADP - A + ATP ----> M - ATP + A + ADP
Ако в този момент пристигне нов нервен импулс, тогава реакцията„повторно зареждане“ се повтаря, ако следващият импулс не пристигне, настъпва мускулна релаксация. Връщане на свития мускул по време на релаксация към резултатаТова състояние се осигурява от еластичните сили на протеините на мускулната строма. Излагайки съвременни хипотези за мускулна контракция, учените предполагат, че в момента на свиване актиновите нишки се плъзгат по миозиновите нишки и те също могат да бъдат съкратени поради промяна в пространствената структура на контрактилните протеини (промени във формата на спиралата).
В покой АТФ има пластифициращ ефект: комбинирайки се с миозин, той предотвратява образуването на срастванията му с актин. Разделяйки се по време на мускулна контракция, АТФ осигурява енергия за скъсяване на срастванията, както и работата на „калциевата помпа“ - доставката на йони Ca ++. Разграждането на АТФ в мускулите се случва с много висока скорост: до 10 микромола на 1 g мускул в минута. Тъй като общите резерви на АТФ в мускула са малки (те могат да бъдат достатъчни само за 0,5-1 секунди работа с максимална мощностНест), за да се осигури нормална мускулна функция, АТФ трябва да се възстанови със същата скорост, с която се състезаваразделя се.
- Гимнастика, която укрепва мускулите на ръцете (физически упражнения за красива фигура)
- Възпалителни мускулни заболявания
- 10 Хранителни правила за мускулен растеж
- 022 "Набутайте нещо неудържимо" или транспортиране на хладилника на Шнив
- Генерал Ермолов