Спектрален анализ (страница 1 от 2)
. Спектри, методи за тяхното получаване, характеристики, класификация и използване за аналитични цели. Основните елементи на спектралните инструменти и тяхното предназначение
Методите за спектрален анализ са методи, основаващи се на определяне на химичния състав и структура на веществата по техния спектър.
Спектърът на веществото се нарича електромагнитно излъчване, подредено по дължини на вълните, излъчено, абсорбирано, разпръснато или пречупено от вещество. Методи, базирани на получаване и изучаване на емисионните (емисионни) спектри на електромагнитното излъчване (енергия), се наричат емисия, абсорбция (абсорбция) - абсорбция, разсейване - разсейване, пречупване - пречупване.
Спектърът на веществото се получава чрез въздействие върху него с температура, електронен поток, светлинен поток (електромагнитна енергия) с определена дължина на вълната (честота на излъчване) и по други начини. При определена стойност на енергията на удара веществото може да премине в възбудено състояние. В този случай се случват процеси, които водят до появата в спектъра на излъчване с определена дължина на вълната (Таблица 2.2.1).
Емисията, абсорбцията, разсейването или пречупването на електромагнитното излъчване може да се разглежда като аналитичен сигнал, носещ информация за качествения и количествения състав на веществото или за неговата структура. Честотата (дължината на вълната) на лъчението се определя от състава на изследваното вещество, а интензивността на лъчението е пропорционална на броя на частиците, предизвикали появата му, т.е. количеството вещество или компонент на смес.
Всеки от аналитичните методи обикновено не използва пълния спектър на веществото, обхващащ диапазона на дължината на вълната от рентгеновите лъчи до радиовълните, а само определена част от него. Спектралните методи обикновено се различават от обхвата на дължините на вълните на спектъра, който работи за този метод: ултравиолетова (UV), рентгенова, инфрачервена (IR), микровълнова и др.
Техниките, които работят в UV, видимия и IR диапазона, се наричат оптични. Те се използват най-вече в спектрални методи поради сравнителната простота на оборудването за получаване и регистриране на спектър.
Оптичните спектри са резултат от промени в енергията на атомите или молекулите.
В резултат на промяна в енергията на атом или молекула, те преминават от основно състояние с възможно най-ниската вътрешна енергия E0 в възбудено състояние с енергия E1. Вътрешната енергия е дискретна (квантова) величина, поради което преходът на атом или молекула от основно състояние в друго винаги е придружен от скок-подобна промяна в енергията, т.е. получаване или отдаване на част (квант) енергия.
Квантовете на електромагнитното излъчване са фотони, чиято енергия е свързана с честотата и дължината на вълната на излъчване чрез известната връзка
където Е = Е1 - Е2, Е1 е началната енергия, а Е2 е енергията на крайното състояние на атом или молекула, между които настъпва преходът; h е константата на Планк; c е скоростта на светлината; - честота; - дължина на вълната на електромагнитното излъчване.
Когато атомът се възбуди, електроните се придвижват от външните запълнени нива към незапълнените по-високи енергийни нива.
Атомът не може да остане дълго време във възбудено състояние. Той се стреми да се откаже от получената излишна енергия и да се върне в невъзбудено състояние. След много кратко време (10-8-10-7s) атомът спонтанно се връща от възбудено състояние в земята или междинно.
Когато електрон премине от горното ниво към долното, се освобождава фотон - квант на излъчване с определени и .
Схематично електронните преходи в атомите между различни състояния, придружени от излъчването и поглъщането на квантите на електромагнитното излъчване, могат да бъдат представени под формата на диаграма (Фигура 2.2.1).
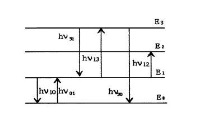
Хоризонталните линии на фигура 2.2.1. изобразява енергийните нива на различни състояния на атома. Нивото E0 е нивото на основното състояние; Е1, Е2, Е3 - нивата на възбудени състояния в реда на увеличаване на тяхната енергия. Вертикалните стрелки съответстват на излъчване (стрелка надолу) или поглъщане () на фотон. Очевидно е, че
01 = 10, 13 = 31 и т.н.
Наборът от фотони, излъчени или погълнати по време на всеки един електронен преход на атом, който създава излъчване с една дължина на вълната, се нарича спектрална линия. Дължината на вълната на спектралната линия може да се определи от съотношението =
Спектърът, дължащ се на прехода при E1 E2, се нарича емисионен спектър, а при E1 E2 - спектър на поглъщане. Преходите и съответните спектрални линии, преминаващи от или към земното енергийно ниво, се наричат резонанс.
За възбуждане на спектрална линия е необходима определена енергия, наречена потенциал на възбуждане. Ако на атома се придаде твърде много енергия, тогава може да настъпи пълното отстраняване на електрона, т.е. йонизация на атом. Необходимата за това енергия се нарича йонизационен потенциал. Резонансните линии са най-ярките и имат най-ниския потенциал на възбуждане.
Промяната в енергията на молекулата е придружена от промяна както на енергията на вибрациите, така и на въртенията, т.е. молекулата няма чисто електронни преходи и са възможни само електронно-вибрационно-ротационни (EVR) преходи. Броят на възможните EKR преходи в молекулата е много по-голям от този на атомите; следователно, като правило, спектрите на молекулите са по-сложни и се състоят от по-голям брой спектрални линии в оптичния диапазон на дължината на вълната. Схематична диаграма на енергийните нива на молекулата може да бъде представена по следния начин (фиг. 2.2.2).
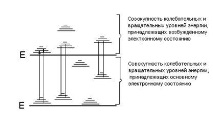
Фиг. 2.2.2. Диаграма на енергийното ниво на молекулата
Не всички възможни преходи се проявяват както за молекули, така и за атоми. Преходите се регулират от така наречените правила за подбор: преходите са разрешени, когато квантовото число се променя с единица (например Sp, pd и др.).
За аналитични цели могат да се използват както емисионните, така и абсорбционните спектри, тъй като са взаимно свързани. Например светлината, излъчвана от нажежаеми натриеви метални пари, предавани през призма, създава две много близки жълти линии с дължини на вълните 589,0 и 589,6 микрона. Това са така наречените натриеви D линии. От друга страна, ако преминете полихроматична бяла светлина (т.е. набор от светлинни лъчи с всички дължини на вълните) през натриева пара и след това я разложите на цветни компоненти в стъклена призма, след това на фона на непрекъснат спектър, две черни линии ще бъдат открити точно на място D - линии. Следователно натриевите пари абсорбират лъчението с точно дължините на вълната, които те излъчват при възбуждане.
Това е общо правило; следователно спектралният анализ може да се извърши както в емисионния спектър, така и в абсорбционния спектър. Първият метод е удобен за анализ на материали, при които емисионният спектър на съставните вещества, например метали и газове, се възбужда лесно, а вторият е по-удобен за анализ на материали, в които е трудно да се възбуди съставната част вещества (например разтвори).
Емисионните спектри се разделят на непрекъснати, лентови и линейни спектри (фиг. 2.2.3). Непрекъснатите (или непрекъснатите) спектри съдържат всички дължини на вълните в определен интервал.
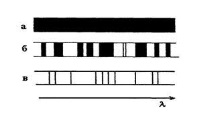
Те се излъчват от нажежаеми, които са на такова разстояние един от друг, че тяхното излъчване може да се счита за независимо. Газовете и парите на металите имат линейни спектри.
Линиите в спектрите на атомите не са подредени произволно, а са обединени в групи, наречени серии. Разстоянията между линиите в поредицата естествено намаляват с преминаването от по-дълги вълни към по-къси.
Балмеер установява за най-простия линеен спектър на водорода, че честотите на спектралните линии в серии, разположени в различни области на електромагнитното излъчване, са в определена редовна връзка помежду си, което като цяло за всички елементи се изразява чрез зависимостта
- Стандартни техники и методи за анализ на счетоводни (финансови) отчети
- Билки за миома на матката, как да се използва и пие - такси за лечение, Сайт за методите на лечение на лекарите
- Има ли алтернативни методи
- Топ и методи за кражба на автомобили
- Модел за технически анализ Двойно отгоре и Двойно дъно (отдолу)