Заместители на донори
Бензенната молекула е симетрична и следователно всички въглеродни атоми са абсолютно еквивалентни при образуването на монозаместени продукти на реакцията. Ако в ядрото на бензола вече има заместител и ние въведем друг заместител там, тогава могат да се образуват следните орто- и параизомери. Позицията, която следващият заместител ще заеме, се определя от естеството на първоначалния заместител (неговите $ +/- І $ и +/- M ефекти). Съответно заместителите могат да бъдат разделени на две групи - заместители от първия вид и заместители от втория вид, които от своя страна включват заместители, които имат индуктивен и мезомерен ефект от различен знак.
Заместник от първия вид
Заместители от първи вид (орто и пара-ориентанти в реакции на заместване) са атоми или групи атоми, които са донори на електрони. С изключение на алкиловите радикали ($ Alk- $), те имат свободни електронни двойки върху атом, който е директно свързан с ароматното ядро:
Обогатяването на ароматното ядро с електронна плътност ускорява реакциите на електрофилно заместване.
Опитайте се да помолите учителите за помощ
По този начин механизмът на ориентиращото действие на заместителите от тип $ I $ е, че те увеличават степента на делокализация на положителния заряд на $ \ sigma $ -комплекса в сравнение с незаместения $ \ sigma $ -комплекс на бензола. Това означава, че стабилността на такъв $ \ sigma $ -комплекс се увеличава и енергията на активиране намалява, което води до ускоряване на реакцията. Нека разгледаме сравнението на относителната стабилност на o-, m- и $ \ pi- \ sigma $ -comilexiv, като използваме примера на реакцията $ Se $ за фенол:
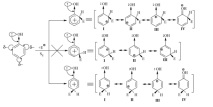
Горната диаграма показва, че в случай на орто- и пара- $ \ сигма $-комплекси, делокализацията на заряда е възможна поради четирите ограничаващи структури на $ (I-IV) $, докато в случая на мета- $ \ sigma $ -комплекс такава делокализация е възможна само за преброяване на три гранични структури $ (I-III) $, така че реакцията $ SE $ протича главно в орто и пара позиции.
Задайте въпрос на специалисти и вземете
отговор за 15 минути!
Заместители, които проявяват $ + I $ -ефект
Заместителите, които проявяват $ + I $ -ефект, включват атоми на елементите, по-малко електроотрицателни от въглерода: алкални метали; бор; групи атоми с общ отрицателен заряд върху атом, свързан директно с въглерод; алкилови групи. $ + I $ -Ефектът е толкова по-голям, колкото повече вляво и под елементите в периодичната таблица са разположени:
Алкиловите групи се характеризират със слаби електронодонорни свойства и проявата на техния $ + I $ -ефект зависи от структурата на въглеводородния остатък. И така, третичните алкилови групи проявяват по-голям и първичен - най-малък $ + I $ -ефект:
Заместители, които проявяват + M-ефект
Тези заместители включват предимно аниони - силни донори на електрони. В рамките на една група елементи + M-ефектът на анионите намалява с увеличаване на заряда на атомното ядро:
За неутралните атоми + M-ефектът се променя със същата последователност, но ефектът му е много по-малък, отколкото за съответните аниони:
Този модел е свързан с такива фактори:
- колкото по-голям е броят на периода, в който се намира елементът, толкова по-голям е размерът на външната $ p $ -орбитала и толкова по-малка е възможността за нейното конюгиране с $ p $ -орбиталата на въглерода;
- с увеличаване на размера или екстремната орбитала на даден елемент, средната му електронна плътност, а оттам и електронодонорните свойства на тази орбитала намаляват.
В рамките на периода + М-ефектът също нараства с намаляване на заряда на атомното ядро.
В допълнение, способността на заместителя да проявява + М-ефект се увеличава с намаляване на електроотрицателността на атома.
Не намерих отговора
на вашия въпрос?
Просто пиши с това, което ти
нужда от помощ
- Заместители на донори - Наръчник на химика 21
- Как да видим пророчески съновидетелен заговор
- Как да съставяте документи за получаване на руска пенсия в Молдова
- Промяна на цвета на капсулата
- Промени в акцизите върху алкохола