Технологии и информационни системи
Възможности за използване на технологията PROTEIN MICROARRAY (микрочипове) за анализ на протеиновия състав на кръвен серум
Автори: Н.Г. Туманова, М.В. Климушин, В.А. Metelskaya, S.A. Бойцов.
Обобщение
Технологията Microchip е удобен и относително икономичен инструмент за анализ на специфични биомаркери, за да се диагностицират заболявания, да се оцени ефективността на терапията и да се изследват сигналните пътища. За да анализираме протеиновия състав на кръвния серум, тествахме някои видове готови микрочипове, които преди това не се използваха в Русия. Успяхме да открием 2% и 5% от матрицата на чипса, в зависимост от техния вид, без предварително изчерпване на суроватката (отстраняване на протеини на основни фракции). По този начин частичният протеинов състав на кръвния серум може да бъде анализиран с помощта на микрочипове, дори без предварително отстраняване на протеините на основните фракции от него.
Ключови думи: микрочипове; кръвен серум; протеинов състав.
Въведение
Протеиновият микрочип е матрица, съдържаща протеинови молекули или молекули на антитела, предназначена за едновременен анализ на голям брой протеинови компоненти в една проба от всяка биологична течност. Технологията Microchip е удобен и относително икономичен инструмент в сравнение с тандемната масова спектрометрия за анализ на специфични биомаркери с цел диагностика на заболявания, оценка на ефективността на терапията, изследване на сигналните пътища и др.
Първите протеинови микрочипове са разработени в средата на 80-те години, преди развитието на ДНК микрочипове [1], но поради продължителния процес на тяхното усъвършенстване те започват да завладяват областта на приложение в лабораторната практика сравнително наскоро. С развитието на технологиите, които позволяват да се подобри качеството на специфичните антитела срещу различни протеини и да се намалят разходите за тяхното пречистване, по-модерните микрочипове навлизат в нова спирала на развитие и започват да привличат интереса на изследователите като инструмент за сравнително икономичен - времеви анализ на голям брой протеинови маркери в минимални обеми кръвен серум и други биологични среди [2, 3]. Към днешна дата са разработени платформи, които съдържат до 9000 протеина и над 4000 антитела на един предмет. Базираните на антитела микрочипове работят на принципа на Western blot. Важно е избраният продукт да е надежден в експлоатация и, съгласно инструкциите на производителя, да гарантира резултат, който е адекватен на декларираните характеристики. Опитът показва, че това не винаги се случва. Цената на микрочиповете е достатъчно висока, за да сортира продукти от различни производители на сляпо и на случаен принцип, така че информацията за това колко успешни са били определени видове чипове за решаване на конкретни проблеми в реалната лабораторна практика би била полезна за изследователите и би могла да им помогне да спестят своята енергия, време и пари. В момента в руската преса практически няма информация за анализа на протеиновия състав на биологичните среди с помощта на готови микрочипове.

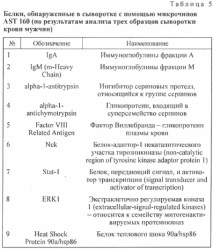
Преди да преминем към решаването на по-фини проблеми, свързани с търсенето на конкретни биомаркери, тествахме някои видове чипове, за да определим най-подходящите за решаване на посочените по-горе проблеми. За да анализираме протеиновия състав на серума, ние избрахме SET 100 Full Moon Biosystems Signaling Explorer Antibody Microarray [4] (оттук нататък SET 100), AST 160 Full Moon Biosystems Signal Transduction Pathway Antibody Microarray (оттук нататък AST 160) (Full Moon Biosystems, САЩ) и PlasmaScan ™ 380 антитяло Microarrays (по-долу PS380) (Arrayit Corporation, САЩ). SET 100 микрочипове съдържат 1358 уникални антитела, участващи в 20 биологични сигнални пътеки в две реплики. AST 160 микрочипове съдържат 165 високоспецифични антитела в шест реплики, характеризиращи пътищата за предаване на сигнала. PS380 съдържа 380 антитела в шест копия на предметно стъкло, което позволява на касетата за хибридизация да анализира едновременно 6 различни проби на един предмет. Известно е, че у нас тези видове чипове не са били използвани. Списъкът с протеини, които трябва да се определят с помощта на микрочипове, се съдържа в съответните GAL файлове, които са достъпни за изтегляне от уебсайта на производителя. Съкращението GAL е получено от началните букви на историческото име на списъка с масиви GenePix. Сега това съкращение се е утвърдило като термин и се използва за всички видове микрочипове.

Материали и методи.
Обработка на кръв.
Няколко доброволци взеха кръв на гладно от кубиталната вена. Кръвният серум се получава чрез кръвно центрофугиране при 1000 g в продължение на 20 минути при 4 ° С. След събиране серумът се центрофугира при 10 000 g в продължение на 15 минути при 4 ° С, след което се разпределя в аликвотни части. Аликвотни части се съхраняват при -25 ° С. Концентрацията на протеин в серума е измерена по метода на Lowry [5], калибрирането е изградено с помощта на човешки серумен албумин (HSA). След това серумът се разрежда с фосфатно буфериран физиологичен разтвор (PBS), готов за употреба (Arrayit, САЩ) до крайна концентрация от 100 μg протеин/100 μl. За това серумът първо се разрежда 2 пъти, след това, като се взема обем, съдържащ 100 μg протеин, обемът на PBS се довежда до 100 μl.
Маркирани суроватъчни протеини.
В епруветки за микроцентрифуги с обем от 0,5 ml, поставени в ледена баня, се добавят 100 μl (100 μg протеин) от разреден PBS серум (крайна концентрация 100 μg/μl). След това към пробата се добавят 20 μL протеинов етикетиращ буфер, разреден с вода съгласно инструкциите на производителя (Protein Labeling Buffer, Arrayit, USA; H2O Arrayit, USA Protein Labeling Kit, Arrayit, USA) и се смесва на Vortex миксер. След това 1 μL боя (Arrayit Green 540, готова за употреба) се добавя към пробите с микро спринцовка и се смесва на Vortex миксер. Сместа се инкубира в ледена баня на тъмно в продължение на 1 ч. Флуоресцентните молекули на багрилото ковалентно се свързват с първични амини, осигурявайки директно белтъчно маркиране. Моларното съотношение на багрилото към протеина е 40: 1, т.е. 5-10 молекули багрило на протеин, когато са маркирани със 100 μg протеин. За да се спре реакцията на етикетиране, се добавят 10 μL стоп разтвор (Arrayit, САЩ), смесват се върху Vortex и се инкубират върху лед в продължение на 30 минути на тъмно, за да инактивират молекулите на багрилото.
Гел филтрация за отстраняване на несвързани флуоресцентни молекули на багрилото
Излишните молекули багрило се отстраняват чрез гел филтрация. Колони (въртящи се колони, комплект за етикетиране на Arrayit, Arrayit, САЩ) бяха подготвени през предходния час на инкубация (за всяка проба са разпределени 2 колони). Сухото съдържание на колоните се пълни с 650 μL PBS, енергично се разбърква до пълно разтваряне и образуване на гел. След това гелът се смесва с фина игла за отстраняване на мехурчета. Инкубира се в продължение на 45 минути при стайна температура, за да се хидратира и активира гел матрицата. След това колоните се центрофугират в продължение на 2 минути при 750 g, за да се отстрани PBS. След това готовите за употреба колони се зареждат с 65 μl от получената смес от белязани протеини, което е половината от обема на всяка проба. Колоните се поставят в епруветки за микроцентрифугиране от 1,5 ml за събиране на белязаните белтъци и се центрофугират при 750 g за 2 минути. Несвързаното мастило остана в матрицата на гела на колоните. Добивът на протеин след гел филтрация е около 90%. Белязаните протеини се съхраняват при -26 ° C.
Микрочипове
Избраните от нас микрочипове SET 100 и AST 160 (Full Moon Biosystems, САЩ) и PS380 (Arrayit Corporation, САЩ) са висококачествени стъклени предметни стъкла с размер 76 * 25 * 1 mm, покрити със SD полимер с ковалентно имобилизирани антитела. Списъкът с антитела се съдържа в GAL файловете, прикрепени към микрочиповете. Микрочиповете SET 100 са платформа, съдържаща 1385 антитела в две реплики на един предмет, което позволява паралелно да се анализира една проба за по-точни резултати. AST 160 микрочипове съдържат 165 антитела на предметно стъкло, което позволява да се анализира една проба в шест паралела (вж. Фигурата).
Микрочипът PS380 позволява едновременен анализ на шест различни проби с помощта на касета за хибридизация.
Микрочиповете включват положителни и отрицателни контроли. Положителните контроли са антитела, свързани с Cy3, те са проектирани да позиционират ясно решетката на файла GAL, когато се прилагат върху петна, получени в резултат на сканиране с микрочип. Отрицателните контроли съдържат говежди серумен албумин. Те приличат на празни петна и се използват за отчитане на фона при анализ на изображението.
Подготовка и блокиране на микрочип.
Преди да бъде изваден от опаковката, микрочипът е държан на стайна температура в продължение на 30 минути. След изваждане от опаковката предметното стъкло се оставя да изсъхне за 15 минути. След това предметното стъкло се инкубира в блокиращ разтвор (30 ml) с 0,9 g сухо мляко (Full Moon, САЩ) в продължение на 40 минути на шейкър при стайна температура. След това предметното стъкло се измива десет пъти с дейонизирана вода, като се поставя в 50 ml конична епруветка за центрофуга и се разклаща енергично в продължение на 10 s.
Хибридизация.
Плъзгачът се инкубира в хибридизационна камера в продължение на 2 часа при стайна температура, като се разбърква на шейкър в разтвор на протеинов съединителен смес, съдържащ 6 ml разтвор за свързване, 180 μg сухо мляко и 30 μl белязан белтък. След това предметното стъкло се измива два пъти в 30 ml промивен разтвор (Full Moon, САЩ), като се разбърква в шейкър при стайна температура в продължение на 10 минути. След това микрочипът беше измит десет пъти с дейонизирана вода, както беше описано по-рано. След това предметното стъкло беше изсушено чрез центрофугиране в специална центрофуга (Arrayit, САЩ) и сканирано с помощта на лазерен скенер за микрочипове (InnoScan® Microarray Scanner 900).
Сканиране на микрочипове и анализ на изображения
Микрочиповете бяха сканирани в ръчен режим с настройки: Режим на сканиране - нормален, Скорост = 20 l/s; Лазерна мощност = 5,0 mW; РМТ печалба = 100%; Размер на пиксела = 10 микрона; Дължини на вълните = 532 nm.
След зареждане на GAL файловете и регулиране на решетката в ръчен режим с ориентация в съответствие с положителните контроли, изображението беше анализирано с помощта на програмата Mapix V7.0.0, която дава възможност да се получат до 25 различни характеристики на петна, включително тези с фон изваждане и да се идентифицират петна като протеини съгласно списъка, представен в GAL файлове.
Резултати и дискусия
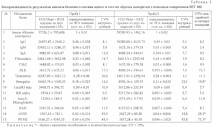
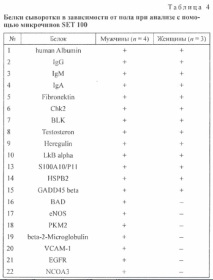
За да се анализира протеиновия състав, като се използват микрочипове SET 100, бяха избрани 7 серумни проби от доброволни донори от мъже и жени (4 мъже и 3 жени). Общо в пробите са открити 22 вида протеини (Таблица 1). От тях 9 вида присъстват постоянно във всички анализирани проби (HSA, имуноглобулини от фракции G, M и A, фибронектин, киназа на контролния пункт на клетъчния цикъл, тирозин протеин киназа Blk, тестостерон, ерегулин), тъй като тези протеини съставляват значителна част от общият протеинов състав на серума; останалите 13 вида протеини присъстват в определени комбинации.
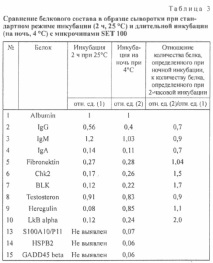
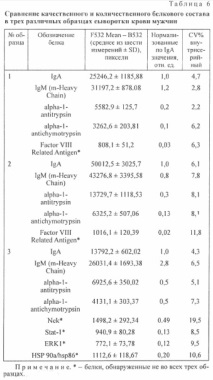
За да се оцени възпроизводимостта на изследвания полуколичествен метод за определяне на протеиновия състав на серума, използвайки SET 100, същата серумна проба беше подложена на повторен анализ (Таблица 2). Когато характеризираме петно, бяхме ръководени от F532 Mean - B532, което е средната интензивност на петно в пиксели минус фона при дължина на вълната 532 nm (зелен лазерен сигнал). Интензитетът на петна в пиксели се нормализира до HRA чрез разделяне на интензитета на получените петна от интензитета на HRA петно. Получените стойности, отразяващи относителното количество протеин, се изразяват в относителни единици (относителни единици). Възпроизводимостта по отношение на качествения състав на анализираните серумни проби е 100%: 15 от 15 открити протеина са възпроизведени по време на повторен анализ. Средно интрасерийният и междусерийният коефициент на вариация (CV%) са съответно 9,4 и 14,4%. Обаче от таблицата. 2 показва, че има някои протеини, чийто коефициент на вариация е повече от 30%. Ние вярваме, че такива отпадащи трябва да се разглеждат индивидуално и евентуално да бъдат изключени от анализа или да се вземат решения относно надеждността на измерването във всеки отделен случай, в зависимост от поставените цели. Когато се използва този метод за анализ на биомаркери, вероятно не си струва да се разглеждат протеини с висок коефициент на вариация като надеждна цел.
За три от 15 протеина (херегулин, eNOS, PKM2) междусерийният CV% е> 15%, за останалите протеини -
- GELAKAN CHAMPION ЗА КУЧЕТА НА МНОГОЦВЕТНИ ЦВЕТОВЕ инструкции за употреба, състав, показания,
- Водоотблъскващ за тротоарни плочи го направете сами
- Bystrumgel - инструкции, приложение, аналози, показания за употреба, състав - Популярни за здравето
- Dalacin (Dalacin) за перорално приложение инструкции за употреба, описание на лекарството
- Bystrumgel (Bystrumgel) - инструкции за употреба, състав, аналози на лекарството, дозировки, странични