Водород в природата (0,9% в земната кора)
Характеристика на водорода
По отношение на лекотата той е първият сред газовете. При нормални условия е без вкус, безцветен и напълно без мирис. Когато попадне в термосферата, той лети в космоса поради ниското си тегло.
В цялата Вселена това е най-многобройният химичен елемент (75% от общата маса на веществата). Толкова много, че много звезди в космоса са съставени изцяло от него. Например слънцето. Основният му компонент е водородът. А топлината и светлината са резултат от освобождаването на енергия, когато ядрата на материала се сливат. Също така в космоса има цели облаци от неговите молекули с различни размери, плътности и температури.
Физически свойства

Високата температура и налягане значително променят качествата му, но при нормални условия те:
• има висока топлопроводимост в сравнение с други газове,
• нетоксичен и слабо разтворим във вода,
• с плътност 0,0899 g/l при 0 ° C и 1 атм.,
• превръща се в течност при температура -252,8 ° С
• става твърдо при -259.1 ° С.,
• специфична топлина на горене 120,9 • 106 J/kg.
Превръщането в течно или твърдо състояние изисква високо налягане и много ниски температури. В втечнено състояние той е течен и лек.
Химични свойства
Под налягане и при охлаждане (-252,87 гр. С) водородът получава течно състояние, което е по-леко по тегло от всеки аналог. Заема по-малко място в него, отколкото в газообразна форма.
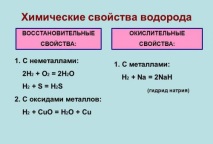
Той е типичен неметал. В лабораториите се получава чрез взаимодействие на метали (като цинк или желязо) с разредени киселини. При нормални условия той е неактивен и реагира само с активни неметали. Водородът може да отдели кислорода от оксидите и да намали металите от съединенията. Той и неговите смеси образуват водородна връзка с някои елементи.
Газът се разтваря добре в етанол и в много метали, особено паладий. Среброто не го разтваря. Водородът може да се окисли по време на горене в кислород или във въздух и чрез взаимодействие с халогени.
Когато се комбинира с кислород, се образува вода. Ако температурата е нормална, тогава реакцията е бавна, ако над 550 ° C - с експлозия (превръща се в експлозивен газ).
Намиране на водород в природата
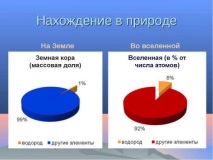
Въпреки че на нашата планета има много водород, не е лесно да се намери в чист вид. Малко могат да бъдат намерени по време на вулканични изригвания, по време на производството на петрол и на мястото на разлагане на органичните вещества.
Повече от половината от общото количество е в състава с вода. Той също така е включен в структурата на масло, различни глини, горими газове, животни и растения (наличието на 50% във всяка жива клетка от броя на атомите).
Водороден цикъл в природата
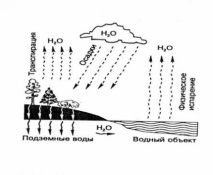
Всяка година колосално количество (милиарди тона) растителни остатъци се разлага във водните тела и почвата и това разлагане изпръсква огромна маса водород в атмосферата. Освен това се отделя по време на всякаква ферментация, причинена от бактерии, горене и заедно с кислорода участва във водния цикъл.
Приложения на водорода
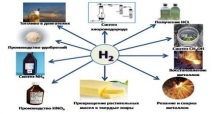
Елементът се използва активно от човечеството в своите дейности, така че научихме как да го получим в индустриален мащаб за:
• като гориво за ракети (течен водород);
• енергетика за охлаждане на електрически генератори;
• заваряване и рязане на метали.
Масата на водорода се използва при производството на синтетичен бензин (за подобряване качеството на нискокачественото гориво), амоняк, хлороводород, алкохоли и други материали. Ядрената енергетика активно използва своите изотопи.
Лекарството "водороден прекис" се използва широко в металургията, електронната промишленост, производството на целулоза и хартия, при избелването на ленени и памучни тъкани, за производството на бои за коса и козметика, полимери и в медицината за лечение на рани.
„Експлозивната“ природа на този газ може да се превърне във фатално оръжие - водородна бомба. Експлозията му е придружена от отделянето на огромно количество радиоактивни вещества и е разрушителна за всички живи същества.
Контактът между течния водород и кожата заплашва тежки и болезнени измръзвания.
- 30 умопомрачителни начини за използване на водороден прекис, за които трябва да знаете!
- Каква е тайната на младостта Здраве и красота от природата
- Въведение, Органи за управление, контрол и надзор за опазване на природата, техните функции - Законодателство относно
- Подаръци от есента фотоизбор на подаръци от природата
- Всички опции за перфектния уикенд в къщите сред природата само за двама, със семейство или приятели