Съвременният модел на състоянието на електрон в атом - ПЕРИОДИЧНО ПРАВО D
Раздел 2. ПЕРИОДИЧНО ПРАВО НА Д. И. МЕНДЕЛЕЕВ И СТРУКТУРАТА НА АТОМИТЕ
§ 2.5. Съвременен модел на състоянието на електрон в атом
По време на химични реакции ядрото на атома не се променя. Електронните обвивки на атомите са обект на промени, чиято структура обяснява много свойства на химичните елементи. Следователно на състоянието на електроните в атома и структурата на електронните обвивки винаги се обръща голямо внимание по време на изучаването на химията.
Състоянието на електрона в атома се описва от квантовата механика, която изучава движението и взаимодействието на микрочастиците, т.е. елементарни частици, атоми, молекули и атомни ядра. Според концепциите на квантовата механика микрочастиците имат вълнова природа и вълните проявяват свойствата на частиците. По отношение на електрона можем да кажем, че той се държи както като частица, така и като вълна, т.е. разкрива, подобно на други микрочастици, дуализъм на частици и вълни (двойственост). От една страна, електроните като частици упражняват натиск, от друга потокът от движещи се електрони е придружен от вълнови явления, например електронна дифракция.
Електронът в атома няма траектория. Квантовата механика разглежда вероятността електрон да се намира в космоса около ядрото. Електрон, който се движи бързо, може да бъде във всяка част от пространството, заобикалящо ядрото, а различните му позиции се считат за облак от електрон с определена плътност на отрицателен заряд. Тя може да бъде представена по-ясно, както следва. Ако беше възможно да се получи моментна снимка на положението на електрона в атом на много кратки интервали (това ще бъде отразено върху него под формата на точка), тогава чрез наслагване на голям брой такива моментни снимки би било възможно за да се получи картина на електронен облак. А там, където има повече точки, облакът има
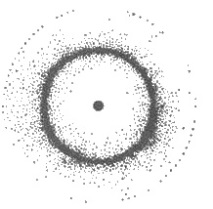
Фигура: 2.2. Електронен облак от водород с неравномерна плътност
най-голяма плътност. Максималната плътност съответства на вероятността електрон да остане в дадена част от атомното пространство. На фиг. 2.2 показва модел на напречното сечение на водороден атом от гледна точка на квантовата механика. Вижда се, че електронната плътност в близост до ядрото е практически нула, т.е. електронът почти никога не е там. С отдалечаване от ядрото електронната плътност се увеличава и достига максималната си стойност на разстояние 0,053 nm, а след това постепенно намалява. Това означава, че задържането на електрон, движещ се на разстояние 0,053 nm от ядрото, е най-вероятно (на фигурата има по-тъмни места). Колкото по-силен е електронът, свързан с ядрото, толкова по-голяма е плътността на разпределението на заряда и по-малък трябва да има електронният облак.
Пространството около ядрото, в което е най-вероятно електронът да се задържи, се нарича орбитала 1 .
1 Терминът е приет през 1962 г. вместо термина "орбита".
Съдържа = 90% от електронния облак. Това означава, че около 90% от времето електронът е в тази част от космоса. Орбиталите на атома са с различни размери. Очевидно е, че електроните, движещи се в по-малки орбитали, са по-привлечени от ядрото, отколкото електроните, движещи се в по-големи орбитали. Електроните, които се движат по орбитали с подобни размери, образуват електронни слоеве. Електронните слоеве се наричат още енергийни нива. Енергийните нива се номерират, започвайки от сърцевината: 1, 2, 3, 4, 5, 6, 7. Понякога те се означават съответно с букви K, L, M, N, O, P, O. Цялото число n, обозначавайки номера на нивото, се нарича основно квантово число. Той характеризира енергията на електроните, заемащи дадено енергийно ниво. Електроните от първото енергийно ниво, най-близко до ядрото, имат най-ниска енергия. В сравнение с електроните от първо ниво, електроните от следващите нива се характеризират с голям запас от енергия. Очевидно електроните от външното ниво са по-слабо свързани с ядрото.
Броят на енергийните нива в атом, изпълнен с електрони, е числено равен на броя на периода, в който се намира елементът: атомите на елементи от I период имат едно енергийно ниво, II период - две, III период - три и т.н. Най-големият брой електрони на енергийно ниво е равен на два пъти квадрата от броя на нивата, т.е.
където N е броят на електроните; l - номер на ниво (броене от ядрото), или основното квантово число.
Според уравнение (2.2), на първото енергийно ниво, най-близко до ядрото, не могат да бъдат разположени повече от 2 електрона, на второто, не повече от 8, на третото, не повече от 18 и четвъртото, не повече от 32.
- Съвременна лъчева диагностика, Модерен лекар
- Модерна телевизионна програма
- Съвременни аспекти на лечението и профилактиката на еризипела, стр. 5
- Какво представлява законът на Мур
- Съвременна магия за осъществяване на желания (шонгома)