ОБРАТЕЛЕН ГАЛВАНИЗИРАЩ ЕЛЕМЕНТ
Устройство, съдържащо два електрода и електролит, при което спонтанно протича химическа реакция, в резултат на което се генерира електрически ток (когато електродите са затворени през външна верига), се нарича галванична клетка.
Има два вида такива елементи, в зависимост от това дали а) химична реакция протича при условия, когато външен ток не тече (необратими елементи), б) или реакцията не протича, ако електродите не са затворени (обратими елементи).
Например в необратим елемент

цинкът реагира спонтанно с киселина и всъщност, дори електродите да не са свързани помежду си, протича ток. Елементите от този тип винаги са необратими от гледна точка на термодинамиката и следователно не представляват теоретичен интерес. Ако прикачите д. и т.н. в посока, обратна на посоката на д. и т.н. елемент, това не връща системата в първоначалното й състояние; вместо това работи като електролизатор.
За да се установи дали галваничният елемент е обратим или не, той е свързан към външен източник на електричество. и т.н. с. по такъв начин, че да балансира точно д. и т.н. елемент; при тези условия в клетката не протича ток и не настъпват химически промени. Ако намалите външния д. и т.н. с някакво безкрайно малко количество, през клетката ще тече ток и ще настъпят химически промени, пропорционални на количеството преминало електричество. От друга страна, ако приложеното д. и т.н. малко повече от д. и т.н. елемент, ток
ще тече в обратна посока и реакцията в елемента ще върви в другата посока. В обратим елемент и двете електродни реакции трябва да бъдат обратими, с други думи и двата електрода трябва да бъдат обратими.
Електрохимичните клетки от този вид ще се държат обратимо само когато протичащият ток има безкрайно малка стойност и системата всъщност е в равновесие.
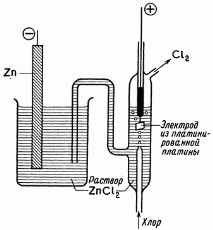
Фигура: 0. 1. Типичен цинково-хлорен елемент.
Ако тече голям ток, се появява градиент на концентрация и елементът вече не е в състояние на равновесие. Това трябва да се вземе предвид при измерване e. и т.н. обратим елемент с помощта на потенциометър (виж).
В обратим елемент (фиг. О. 1) например

цинкът е в равновесие с цинковия йон в разтвор, а хлорният газ е в равновесие с хлорния йон. Потенциалът на цинковия електрод е отрицателен по отношение на потенциала на хлорния електрод. Ако свържете електродите с външна верига, например чрез потенциометър, в него ще се появи поток
електрони от цинк до хлорен електрод. Това нарушава равновесието на електродите и са необходими повече електрони, за да се поддържа потенциалът на цинковия електрод в равновесие, което се осигурява чрез йонизиране на повече цинк:

Когато електроните достигнат хлорния електрод (чрез външната верига), потенциалът на електрода ще стане по-отрицателен от равновесния потенциал и тогава процесът на възстановяване ще се ускори

който се стреми да върне електрода в състояние на равновесие. Цялостната реакция в клетката е сбор от две електродни полуреакции

и в него се образува цинков хлорид. От съществено значение е елементът да преобразува свободната енергия [15] от тази реакция в електрическа.
Д. г. С. химичният елемент зависи от концентрацията и следователно от активността [15] на електролита, от налягането на газа в случай на газов електрод и концентрацията на амалгама в случай на амалгамен електрод (вж.). За разглеждания елемент промяната в свободната енергия, съгласно изотермата на Вант Хоф [15], се изразява чрез уравнението



Ако поддържаме постоянно и равно атмосферно налягане и обозначаваме моларността на хлорида
цинк в разтвор, тогава

Измервайки (елемент) при различни (малки) стойности, изградете графика в координати, спрямо която представлява права линия; в точката на пресичане с ординатата, получаваме от това можем да изчислим
Друга често използвана проста галванична клетка се състои от водородни и сребърни хлоридни електроди:

Реакциите протичат в този елемент

За даден елемент, както е посочено по-горе, Е е положителен и следователно директната реакция протича спонтанно. Промяна на e. и т.н. елемент с концентрация може да се получи с помощта на уравнението на Нернст (виж) за електродните потенциали:

Когато се поддържа постоянно и равно на атмосферното налягане

тогава графиката на зависимостта от е линейна и точката на пресичане с оста на ординатите съответства на стойност, която е, тъй като за водороден електрод
Общо уравнение за e. и т.н. от обратими елементи има формата

където е броят на електроните, участващи в процеса.
Изследване на Е. и т.н. обратими галванични клетки ви позволява да определите стандартния електроден потенциал (вижте), равновесната константа [15] и коефициента на активност [15].
- НЕВЪЗМОЖЕН ГЪЛВАНОВ ЕЛЕМЕНТ превод от руски на английски, превод от руски на английски
- Обратима галванична клетка - Велика енциклопедия на нефт и газ, статия, страница 3
- Деактивирайте ActiveX контролите за Skype за бизнес уеб приложение - поддръжка на Office
- Методи за галванопластика, ElKhimMet
- Културно-образователната среда като фактор на образованието