Нитро съединения
1.1. Методи за получаване на нитросъединения
1.2. Реакции на нитро съединения
1.2.1. Тавтомеризъм на алифатни нитросъединения
1.2.2. Кондензация на алифатни нитросъединения с алдехиди и кетони
1.2.3. Възстановяване на нитро съединения
Нитро съединенията са въглеводородни производни, в които един или повече водородни атоми са заменени с нитро група -NO2. В зависимост от въглеводородния радикал, към който е прикрепена нитрогрупата, нитросъединенията се разделят на ароматни и алифатни. Алифатните съединения се разграничават като първични 1o, вторични 2o и третични 3o, в зависимост от това дали нитро групата е свързана към въглеродния атом 1o, 2o или 3o.
Нитрогрупата -NO2 не трябва да се бърка с нитритната група -ONO. Нитро групата има следната структура:
Наличието на пълен положителен заряд върху азотния атом определя наличието на силен -I-ефект в него. Наред със силния -I-ефект, нитро групата има силен -M-ефект.
Контрол. 1. Разгледайте структурата на нитро групата и нейното влияние върху посоката и скоростта на реакцията на електрофилно заместване в ароматното ядро.
1.1. Методи за получаване на нитро съединения
Почти всички методи за получаване на нитросъединения вече са обсъдени в предишните глави. Ароматните нитро съединения обикновено се получават чрез директно нитриране на арени и ароматни хетероциклични съединения. Нитроциклохексанът се получава промишлено чрез нитриране на циклохексан:
(един)
Нитрометанът също се получава по същия начин, но при лабораторни условия се получава от хлороцетна киселина в резултат на реакции (2-5). Ключовият етап от тях е реакцията (3), която протича през SN2.
(2)
Хлорооцетна киселина Натриев хлороацетат
(3)
(4)
(пет)
1.2. Реакции на нитро съединения
1.2.1. Тавтомеризъм на алифатни нитросъединения
Благодарение на силните свойства на изтегляне на електроните на нитро групата, а-водородните атоми имат повишена подвижност и следователно първичните и вторичните нитро съединения са C-H-киселини. Така че нитрометанът е доста силна киселина (рКа 10.2) и в алкална среда лесно се превръща в резонансно стабилизиран анион:
(6)
Нитрометан pKa 10.2 Резонансно стабилизиран анион
Упражнение 2. Напишете реакциите на (а) нитрометан и (б) нитроциклохексан с воден разтвор на NaOH.
1.2.2. Кондензация на алифатни нитросъединения с алдехиди и кетони
Нитрогрупата може да бъде въведена в алифатни съединения чрез алдолната реакция между нитроалкан аниона и алдехида или кетона. В нитроалканите а-водородните атоми са дори по-подвижни, отколкото в алдехидите и кетоните и следователно те могат да влязат с алдехиди и кетони в допълнение и реакции на кондензация, осигурявайки техните а-водородни атоми. Реакциите на добавяне обикновено протичат с алифатни алдехиди и само кондензация с ароматни алдехиди.
И така, нитрометанът е прикрепен към циклохексанон,
(7)
но кондензира с бензалдехид,
(8)
И трите водородни атома на нитрометан участват в реакцията на присъединяване с формалдехид и се образува 2-хидроксиметил-2-нитро-1,3-динитропропан или триметилолнитрометан.
(девет)
Чрез кондензация на нитрометан с хексаметилентетрамин, ние получихме 7-нитро-1,3,5-триазаадамантан:
(десет)
Контрол. 3. Напишете реакциите на формалдехид (а) с нитрометан и (б) с нитроциклохексан в алкална среда.
1.2.3. Възстановяване на нитро съединения
Нитрогрупата се редуцира до аминогрупата с различни редуциращи агенти (11.3.3). Анилинът се получава чрез хидрогениране на нитробензол под налягане в присъствието на никел на Raney при промишлени условия
(11) (11 32)
В лабораторни условия вместо водород можете да използвате хидразин, който се разлага в присъствието на никел на Рейни с отделянето на водород.
(12)
Нитро съединенията се редуцират с метали в кисела среда, последвано от алкализиране
(13) (11 33)
Могат да се получат различни продукти в зависимост от рН на средата и използвания редуциращ агент. В неутрална и алкална среда активността на конвенционалните редуциращи агенти спрямо нитро съединения е по-ниска, отколкото в кисела среда. Типичен пример е редукцията на нитробензол с цинк. При излишък на солна киселина цинкът редуцира нитробензола до анилин, докато в буферен разтвор на амониев хлорид до фенилхидроксиламин:
(14)
В кисела среда арилхидроксиламините се пренареждат:
(петнадесет)
p-Aminophenol се използва като проявител във фотографията. Фенилхидроксиламинът може допълнително да се окисли до нитрозобензен:
(16)
Редукцията на нитробензол с калай (II) хлорид дава азобензол, а цинк в алкална среда - хидразобензен.
(17)
(18)
Чрез обработка на нитробензол с алкален разтвор в метанол се получава азоксибензен, докато метанолът се окислява до мравчена киселина.
(19)
Известни методи за непълна редукция и нитроалкани. Един от индустриалните методи за производство на найлон се основава на това. Чрез нитриране на циклохексан се получава нитроциклохексан, който се превръща чрез редукция в циклохексанонов оксим и след това, чрез пренареждането на Бекман, в капролактам и полиамид - първоначалното вещество за приготвяне на фибри - капрон:
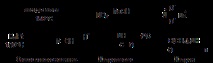
Редукцията на нитро групата на продуктите за добавяне на алдол (7) е удобен начин за получаване на b-амино алкохоли.
(20)
Използването на сероводород като редуциращ агент позволява една от нитро групите да бъде редуцирана в динитроарени:
(11 34)
(21)
Упражнение 4. Напишете редукционните реакции на (а) м-динитробензен с калай в солна киселина, (б) м-динитробензол с водороден сулфид, (в) р-нитротолуен с цинк в буферен разтвор на амониев хлорид.
Упражнение 5. Пълни реакции:
а) (б)
Според систематичната номенклатура амините се наричат чрез добавяне на префикса амин към името на въглеводорода. Според рационалната номенклатура те се считат за алкил или ариламин.
Метанамин Етанамин N-метилетанамин N-етилетианамин
(метиламин) (етиламин) (метилетиламин) (диетиламин)
N, N-диетилетанамин 2-аминоетанол 3-аминопропан
триетиламин) (етаноламин) киселина
Циклохексанамин Бензенамин N-метилбензенамин 2-метилбензенамин
(циклохексиламин) (анилин) (N-метиланилин) (о-толуидин)
Хетероцикличните амини се наричат от съответния въглеводород чрез вмъкване на префикса aza-, diaza- или triaza-, за да се обозначи броят на азотните атоми.
1-азациклопета-1,2-диазациклопета-1,3-диазациклопета-
- Кашлица с лямблиоза при деца
- Мисо супа със скариди - рецепта стъпка по стъпка със снимка нататък
- Опънати тавани Stroy Service - отзиви и мнения на хора
- Мисо супа със скариди рецепта 👌 със снимка стъпка по стъпка, Как да готвя първи ястия
- Мисо супа със скариди