Велика енциклопедия на нефт и газ
Афинитетна хроматография
Терминът афинитетна хроматография обаче поражда (и все още продължава да поражда) много възражения. В много случаи обаче не е толкова лесно да се очертае ясна граница между биоспецифичен комплекс и комплекс, образуван в резултат на действието на неспецифични хидрофобни взаимодействия, както може да изглежда на пръв поглед. [31]
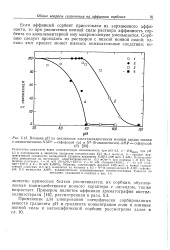
Пример е афинитетната хроматография на ацетил холинестераза [16], разгледана в раздел. [33]
Търсенето и разработването на нови неразтворими носители са най-важни за развитието на афинитетна хроматография и обездвижване на ензимите. Разследванията в тази посока са необходими за въвеждането в практиката на методите, които са били използвани по основния начин. Тъй като все още не е създаден носител, който да отговаря напълно на всички изисквания, е необходимо да бъдете много внимателни при избора на носителя и метода на закрепване на лиганда към него, като се вземе предвид възможността за практическото му приложение, тъй като както и икономически съображения. [34]
Заявленията за афинитетна хроматография са много и разнообразни и не се ограничават до изброените по-горе. Следващите раздели дават някои примери, които илюстрират възможностите на афинитетната хроматография. [35]
Специален вариант на афинитетна хроматография е свързан с използването на хелатни сорбенти. Върху матрицата се фиксира хелатиращ агент, след което чрез преминаване на разтвор на съответната сол колоната се зарежда с йони Cu2, Zn2, Co2 и др. Протеините, способни да образуват комплекси с тях, се задържат върху тези йони по време на хроматографията . [36]
Успехът на метода на афинитетна хроматография е свързан със създаването на биоспецифични сорбенти, способни да свързват вещества в разтвор въз основа на взаимодействието на ензим - субстрат, ензим-инхибитор, антиген-антитяло. Потискането на сорбционните свойства на биоспецифичните сорбенти (инактивиране на активни центрове) често се наблюдава, когато веществата се изолират от екстракти или културни течности без предварително пречистване. В това отношение основните успехи на афинитетната хроматография са свързани с подготвителни лабораторни процеси за изолиране на протеини, включително ензими, след използване на предварителните етапи на тяхното пречистване. Мащабирането на тези процеси и многократното използване на биоспецифични сорбенти, особено при работа с многокомпонентни разтвори, поради посочените причини, често срещат определени трудности. [37]
Специфичността на методите на афинитетна хроматография, заедно със селективната сорбция на кетоаминовата фракция на Hb Ale на PAAG, се определя чрез спектрофотометрично откриване на тема с максимална оптична плътност при дължина на вълната 415 nm. Това обстоятелство прави възможно избягването на изкривяването на резултатите от анализа поради наличието на други гликирани протеини на еритроцитите или кръвната плазма. [38]
Редица афинитетни хроматографски методи, използвани за пречистване на специфични РНК, се основават на химичното взаимодействие на живачни (II) йони със сулфхидрилни групи. Такива производни, за разлика от естествената РНК, са способни да се свързват плътно с агароза, съдържаща сулфхидрилни групи при ниска йонна сила. [39]
Афинитетната хроматография се основава на специфичното взаимодействие на протеини (или други биологични молекули) с лиганди, имобилизирани от ковалентни връзки върху неразтворим носител. Например, ензимът може да взаимодейства с имобилизиран субстрат или субстратен аналог, имобилизиран лектин може да взаимодейства с въглехидратен остатък на гликопротеин или рецепторен протеин със специфичния му лиганд. [40]
Адсорбенти за афинитетна хроматография обикновено се състоят от три ковалентно свързани компонента, неразтворим носител, стъбло (спейсър) и специфичен лиганд. [41]
Важно предимство на афинитетната хроматография е фактът, че хидролитичните ензими (протеази, нуклеази и др.) Са отделени от техните субстрати още в самото начало. По-специално, това обстоятелство е отговорно за високия добив на пречистени макромолекулни препарати, което е характерно за афинитетната хроматография. [42]
Въпреки че принципът на афинитетна хроматография е много прост и интуитивен, от горните кратки забележки е лесно да се разбере, че конструкцията на афинитетен обменник за пречистване (или фракциониране) на желаното вещество е доста деликатна материя. [43]
Условията за провеждане на афинитетна хроматография зависят от естеството на съединението, което се изолира. Съществуват обаче редица общи изисквания относно свойствата на неразтворимия носител, избора на типа афинитетен лиганд, свързването му с носителя, условията на адсорбция и елуиране. [44]
Завършвайки разглеждането на афинитетна хроматография на протеини, трябва да се отбележи, че свързаната област на подготовка и използване на имобилизирани ензими е останала извън нашето зрително поле. Голяма част от казаното за методите за засаждане на лиганди върху активирани матрици е пряко свързано с тази област. Използването на имобилизирани ензими обаче е само косвено свързано с обхвата на физикохимичните методи за изследване на протеини и нуклеинови киселини, така че не можем да се спрем на него поради липса на място. [45]
- Хибридна схема - Велика енциклопедия на нефт и газ, статия, страница 1
- Хидропневматично задвижване - Голяма енциклопедия на нефт и газ, статия, страница 1
- Хидроксиетилцелулоза - голямата енциклопедия на нефт и газ, статия, страница 2
- Глинена материя - Голяма енциклопедия на нефт и газ, статия, страница 1
- Абразивно спояване - Голяма енциклопедия на нефт и газ, статия, страница 1