Травматично увреждане на мозъка и инсулт
В началото на краниоцеребралната патология (фактори от първи ред) при травма или инсулт, механизмът на възникване на локален първичен фокус на деполяризация (обемен процес - градиент на вътречерепно налягане в резултат на вибрации, ротация, импулс на цереброспиналната течност, кръвоизлив) е от решаващо значение. Травматичната реакция се проявява с локален реактивен оток (в рамките на 24 часа) и първична вътречерепна хипертония.
Особено често стволовите участъци са повредени, в непосредствена близост до твърдата мозъчна обвивка, която или просто покрива черепните кости, или образува свои неподвижни образувания (сърп, мозъчен тентор). Преобладаването на определени признаци се осигурява от локалното развитие на съдовата мрежа; близостта на местоположението на ядрата; полисинаптичната природа на нервната тъкан, по-специално ретикуларната формация. Изключването му е особено забележимо, тъй като в същото време неговите активиращи и синхронизиращи ефекти върху висшите и долните части на централната нервна система отпадат. Напротив, най-добрите резултати се получават при ограничени инфаркти на багажника, когато симптомите се изразяват само в булбарна или псевдобулбарна парализа (до 47% от пациентите с изолирани дихателни нарушения оцеляват, т.е. без загуба на контрол върху други жизненоважни функции).
Факторите, които увреждат, са системни и локални хидродинамични нарушения (микроциркулация на кръвта, цереброспинална течност), водещи едновременно до нови механични увреждания на мозъчната тъкан (нарушение под мозъчния тенториум, в големия тилен или трефинен отвор) и до метаболитни нарушения (хипоксия, ацидоза, ацетилхолин, хистамин и други продукти с локален катаболизъм.
Съществена роля за възникването на тези състояния играе т.нар. първична централна холинергична реакция. Същността му е, че дразненето на парасимпатиковите ядра води до масивна енерготропна контрарегулация с „дистония“, локална (вазоконстрикция със застой и агрегация на кръвни клетки) и системни хидродинамични нарушения. На свой ред отклоненията в хидродинамиката и в ендокринно-хуморалното състояние водят до влошаване на нарушенията във вътречерепните водни условия и водния обмен. И така, с повишаване на вътречерепното налягане и паралелно възпрепятстване на кръвообращението, функциите на мозъчната кора страдат, а суббуберните центрове - диенцефалният синдром - отпадат от неговото влияние. Той е придружен от прилив на хиперкатаболизъм с хиперпнея, мускулна и артериална хипертония, с хипергликемия, хипертермия и др. ... На определен етап и в леки ситуации те имат компенсаторна стойност: благодарение на тях мозъкът, дори и с намален кръвен поток, е в състояние да извлече максимално възможното количество хранителни вещества и стимуланти. Но след това, с повишаване на кръвното налягане, артериалния приток към мозъка и вътречерепното налягане се възбуждат механизми за контрол на вътречерепната хидродинамика. По-специално, хипокапнията действа в същата посока, съпровождайки увеличената белодробна вентилация. Те причиняват стесняване на мозъчните артериални съдове, което поне по някакъв начин ограничава артериалния приток. Но с намаляване на pCO 2 под 19 mm Hg. Изкуство. това стесняване става прекомерно. Едновременната утайка на формени елементи поради тяхната деполяризация от увредени тъкани влошава исхемичното увреждане на мозъка (и миокарда). Напротив, хиперкапнията (например при паралелна обструкция на дихателните пътища) е придружена от вазодилатация и увеличен приток на кръв към мозъка. Резултатът, както винаги, се определя от много фактори. По този начин, с изразени локални първични отоци, придружаващи тежки наранявания, когато вътрешните механизми на стабилизация на ICH не могат да се справят с техните функции, се появява нова вълна от вторично генерализиран оток. Осигурява се както от хидродинамичен компонент (преобладаване на артериалния приток над венозен отток), така и от метаболитен (преобладаване на разпадането над синтеза).
В този случай всичко се случва както в амортисьорите на автомобил, когато е прекалено натоварен - нови порции цереброспинална течност се изместват от вентрикулите на мозъка в гръбначното пространство. По същия начин нови части от венозна кръв се изстискват от мозъчните вени през синусите в системата на горната куха вена. С използването на тези амортизационни хидромеханични компенсаторни процеси и изстискване на съдържанието на вентрикулите извън черепа, възможностите на анатомичните механизми за стабилизиране на ICH се изчерпват. В допълнение, трофичните нарушения, придружаващи стагнация и оток, са придружени от катастрофално бързо увреждане на клетките с техния оток (подуване) и трансминерализация. В този случай вторичният белтъчен транссудат прониква в неклетъчното пространство на медулата (интоксикация с глиална вода), откъсвайки клетките както една от друга, така и от съдовете, разделяйки тези образувания анатомично и функционално (разединяване на арефлексията). В тежки случаи трансминерализацията с клетъчен оток може да се развие в състояние на злокачествен декомпенсиран глиален оток, когато миелиновото покритие на невроните е разрушено; глията е фрагментирана; образуват се пергилиарни „езера“, в които се носят кръвни клетки и клетъчни фрагменти.
Най-забележимите нарушения както на трофизма, така и на функциите възникват на местата, където мозъкът се прилепва към твърди вътречерепни образувания - в мозъчната кора на вътрешната повърхност на черепната кост; в краката на мозъка близо до острите предни ръбове на мозъчния мозък; в предните секции на сърпа; в маслини на малкия мозък при foramen magnum; в черепните нерви на грудковата основа на черепа. Скоростта на поява на тези усложнения зависи от скоростта на развитие и локализация на обемния процес.
Веднага щом вътречерепното налягане се доближи до налягането в мозъчните капиляри (около 300 mm воден стълб), кръвният поток в тях спира. Съответно, стволовите функции отпадат и кръвното налягане спада необратимо. Още преди това промените в вътречерепното налягане водят до измествания (размествания) на церебралната маса и са придружени от появата на интерстици (удушени мозъчни хернии) в естествените отвори и цепнатини на черепа. В появата им участват два механични компонента. Едното се дължи на тежестта на самия мозък (гравитационно), а другото се дължи на градиентите на хидродинамичното налягане (хидродинамично). Посоката на гравитацията винаги е постоянна - към центъра на Земята и хидродинамична - винаги в посока на най-малкото противоналягане - под мозъчния тентор, към големия тилен или трепанационен отвор. В хода на тези размествания се получава компресия и огъване на венозните съдове. В по-голяма степен това се отнася до мястото, където вътрешните мозъчни вени и долният сагитален синус навлизат в правия синус, минаващ по мозъчния тенториум, както и в сигмоидния синус във вътрешната югуларна вена.
На този етап към спонтанните увреждащи фактори от втори ред се присъединяват ятрогенните, свързани с „непоправимото” желание на медицинските работници да поставят жертвата по гръб. В това положение насочеността на гравитационния и хидродинамичния компоненти съвпада, което осигурява катастрофално бързо нарастване на мозъчните увреждания. Тежестта на мозъка по острите ръбове на мозъчния тенториум „смазва“ долните външни части на краката на мозъка, окуломоторните, блоковите и тригеминалните нерви. Успоредно с това, под тежестта на мозъка, силвиевият акведукт се компресира, което води цереброспиналната течност през четвъртата камера до гръбначното пространство. Това блокира ликвородинамиката и провокира бързо нарастване на ICP. Заедно с тежестта на мозъка, той „изстисква“ ствола и малките маслини в големия тилен отвор.
Ограничените зони обикновено са отговорни за регулирането на важни и следователно лесно наблюдаеми функции. Компресията на краката на мозъка се причинява от бързо прогресираща глухота, преминаваща при липса на външни прояви на съзнанието. Но често пациентът е в състояние да чуе (слуховият нерв не е повреден) и да си спомни какво се случва около него. Диенцефалният отдел контролира производството на енергия. Продълговатият мозък е изцяло отговорен за контрола на дихателния автоматизъм, сърдечната честота и комуникацията между мозъка и гръбначния мозък. Грубите и необратими трофични смущения, възникващи в задържаните части, бележат крайния стадий на остра ChMP.
Клетъчните структури са много уязвими. Тази уязвимост се определя от високата скорост на техния обмен. Освен това, най-интензивно обменните са ензимните протеини, които определят посоката в изключително разклонени метаболитни пътища. Най-малко интензивно - нуклеиновите киселини на клетъчното ядро - вид съхранение на информация на клетката. Посоката на метаболизма (анаболен или катаболен) до голяма степен се определя от активността на вътреклетъчните лизозомни хидролази, която се увеличава с пренасянето и подкисляването (протонизацията) на вътреклетъчната среда.
Значението на прекомерното протониране е описано по-горе в раздела за киселинно-алкалното равновесие. Припомняме само, че барикадирането на метаболитните пътища с протони води до клетъчна смърт, която идва чрез добре познати и разбираеми явления:
- прекратяване на производството на енергия и в същото време енергозависими процеси на обновяване, неспецифични и специфични клетъчни функции;
- взаимно активиране на клетъчни хидролази (автолитични ензими), вътреклетъчно разграждане, клетъчна хиперосмия и неудържим клетъчен трансфер.
И все пак, при тези условия и аноксия, и обезкървяване (исхемия), и стагнация, мозъчната тъкан в продължение на доста дълго време е в състояние да поддържа способността да генерира енергия и всъщност жизнеспособността. „Животворната“ роля се играе от:
- първо, количественото преобладаване на концентрациите на субстрати (първоначални продукти за веригата на метаболитните процеси) над крайните продукти (мозъкът няма значителни резерви) и
- второ, обучението на механизми за разтоварване на протони.
Естествено, за функционирането на тази многоканална, конвейерна метаболитна система трябва да има достатъчно голям резерв от субстрати-носители, способни да приемат тези прехвърлени протони и да ги задържат (отлагат) до „по-добри времена“. Подобна функция може да се изпълнява от така наречените метаболитни шунтове и задънени улици (по отношение на ситуацията е по-добре да ги наричаме протонни торбички, дивертикули или капани, подобно на паркинги и капани, които оборудват магистрали по магистрали и при остри завои на планински авто-серпентини). Техните възможности могат да бъдат разширени чрез предварително обучение на съответните ензимни системи (Коростовцева Н.В., 1973).
Първата връзка в системата за приемане на протони е системата NAD и NADP, която осигурява активен трансфер на протони между субстратите. Най-известният в тази роля е лактатният задънена улица, чийто капацитет, според A. Labori (1967), е около 7 mM/l лактат. Малко лекари знаят за съществуването на глицерофосфат (Boxer G.E., Devlin T.M., 1961; Smith R.E., Holier D.J., 1962), глутамат, аспартат, цис-аконит, глиоксилни и други шунтове. Междувременно те също активно участват в освобождаването на протони и в реактивирането на NAD и NADP, които след това са в състояние да се включат отново в процесите на производство на енергия.
С натрупването на междинни продукти обаче градиентът на концентрация между субстратите и реакционните продукти неизбежно се изглажда. Темпото на последното се забавя. Вярно е, че консумацията на енергийни вещества също се забавя. По този начин при потисната автолиза умирането е по-обратимо, толкова по-голям е енергийният резерв и капацитетът на протонните торбички (концентрацията на съответните ензими). На първо място, той има превантивна стойност - да предпазва мозъка от последствията от предстоящата хипоксия или исхемия.
В условията на вече завършена исхемия (ПОСТИСХЕМИЧЕН период) и възстановено напояване на клетките (включително кислород и налични субстрати), има нужда не от консервация, а от най-бързото възстановяване на митохондриалното окислително фосфорилиране. Ясно е, че е възможно да се „помръдне“ спряното „колело на Кребс“, да се възстанови естествената посока и скорост на обмен с „нулеви“ градиенти на концентрация, а освен това в максимално „протонирана“ среда е възможно само с енергичен „метаболитен импулс“, дължащ се на субстрата „зад вода“, като същевременно активира следните два механизма:
- отваряне на ключалката (повторно окисляване на NAD и NADP);
- изхвърляне на "отработени" субстрати от метаболитната магистрала и от протонните торбички извън клетката.
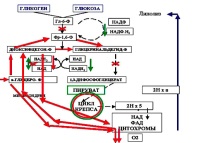
Стойността на субстрата е от най-голямо значение, тоест "лекотата" на включване на субстрати в необходимата реакция. Той се определя главно от размера на техните молекули и независимостта от ензимите, които катализират реакциите на ключовите връзки на метаболитния конвейер.
По време на хипоксия много ензими се разграждат от действието на активирани лизозомни протеази. Хексокиназата и фосфофруктокиназата, които катализират метаболизма на глюкозата, очевидно са сред най-чувствителните. В допълнение, клетъчните протеази могат да попречат на свързването на хексокиназата с липопротеините на митохондриалните мембрани, да разрушат ензимите на дихателната верига, съдържащи флавин или хеминови групи, както и да унищожат протеини, съдържащи не-хем желязо. В резултат на това окисляването на дори „обичайна“ глюкоза става непоносимо за „протонирания“ мозък и много по-лесно (особено при паралелна „адекватна“ инсулинова терапия) се насочва „нагоре“ към превръщане в гликоген, отколкото „надолу“ към окисляване в пируват.
Метаболитният импулс може да се осъществи чрез рязко увеличаване на концентрацията на субстрата, който има способността да дарява своите протони директно на компонентите на дихателната верига в последните си звена. Това са свойствата, които системите GABA, ацето-ацетат и глицерат-диоксиацетон-фосфат имат по отношение на цитохромите и сукцинат спрямо връзката FAD (Rappoport, 1964; Shumakov V.I. et al., 1975).
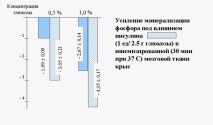
Оказва се, че намаляването на субстратната стойност на глюкозата по време на исхемия е относително лесно обратимо. Във всеки случай, в експеримента (Grushevsky V.E. и Grushevskaya O.A., 1973), мозъчната тъкан, дори след 30 минути пълна исхемия, отново в присъствието на протеиназни инхибитори възстановява способността да използва кислород и неорганичен фосфор.
- Травматично увреждане на мозъка и инсулт - темата на изследователската статия за медицински и здравни изследвания
- Частна линейка
- Лечение на нараняване на очите, първа помощ, видове наранявания
- Последици от травматично мозъчно увреждане (TBI)
- Elokom Lotion, всички въпроси и отговори за Elokom Lotion, линейка онлайн