Механичен момент на многоелектронен атом
АТОМ В МАГНИТНО ПОЛЕ.
ИЗСЛЕДВАНЕ НА ЕФЕКТА НА ZEEMAN.
Цел на работата: запознаване с теоретичните основи на ефекта на Земан, изследване на разделянето на спектралните линии в магнитно поле, определяне на специфичния заряд на електрон с помощта на спектрограми, придобиване на умения за работа с автоматизирана система за събиране и обработка на информация.
Теоретично описание.
Общ ъглов момент на електрон.
Електронна конфигурация на атомите, дадени от квантови числа P и л, ви позволява да разберете периодичната система от елементи и да установите основните закони на оптичните спектри. Фината структура на спектрите зависи от магнитните ефекти, свързани с ъгловия момент на електрона. Преди да разгледаме тези ефекти, нека отбележим как се определя общият ъглов момент на изолиран (единичен) електрон.
Орбитален ъглов момент L и въртящ момент С се добавят според правилото за добавяне на вектори при общия ъглов момент на електрон:
Проекцията на общия момент върху избраната посока (най-често се взема проекцията върху посоката на силовите линии на полето) може да вземе дискретна стойност:
Където, мл Е магнитното квантово число на орбиталния импулс, ms = ±с - магнитно спиново квантово число, - спин на електрон.
Общият ъглов момент на електрон се квантува по обичайния начин:
където квантовото число j (понякога наричан вътрешен квантов номер на общия ъглов момент) е равен на максималната стойност mj.
Защото л има максимална стойност мл, тогава:
(1.2а)
освен това, както следва от формула (1.2a), j може да приема неотрицателни цели числа или полуцели стойности.
При дадена стойност j може би 2j + 1 квантови състояния, различаващи се по стойността на квантовото число mjосвен това:
Например, съгласно (1.3), в случая л = 0 е възможна само една стойност j = 1/2. Кога л = 1 имаме j = 1/2, 3/2, за l = 2 имаме j = 3/2, 5/2. Стойността в определено състояние се характеризира с индекс при буквено обозначение на орбиталния импулс, написан по същия начин като за отделни електрони, но с главни букви: С, P, D, F, G, H. И така, държавата с л = 1 и j = 3/2 се означава като P3/2държава с л = 1 и j = 1/2 - като P1/2.
Нека запишем собствените стойности на ъгловите импулси (орбитални, спинови и общи) и тяхната проекция върху оста Z, известни от курса по квантова физика, в една таблица 1:
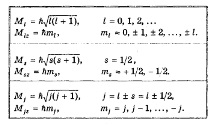
Механичен момент на многоелектронен атом.
Нека сега разширим представената по-горе концепция за общия ъглов момент J един електрон за случая на много електрони (както е в сложния атом). Нека въведем следните нови обозначения:
- общия орбитален импулс на системата от електрони в атома;
- общ въртящ момент на система от електрони в атом.
Както показва изчислението (което пропускаме), общ орбитален импулс система се определя от израза:
Където L Е орбиталното квантово число на получения ъглов момент. В случай на система от две частици с орбитални ъглови импулси l1и l2 квантово число L - цяло, положително - може да има следните значения:
Оттук следва, че L (и следователно полученият момент) може да има 2l1 + 1 или 2l2+ 1 различни стойности (трябва да вземете по-малко на две стойности л). Това е лесно да се провери; например за l1= 2 l2 = 3 получаваме 2 ∙ 2 + 1 = 5 различни стойности L: 5, 4, 2, 1.
Ако системата се състои не от две, а от много частици, тогава квантовото число L, определянето на получения орбитален ъглов момент се намира чрез последователно прилагане на правило (1.4), но няма да се спираме на това, тъй като няма да е необходимо в следващото.
Проекцията на получения орбитален ъглов момент на определена посока Z. се дефинира по подобен начин:
Mz =, мл= 0, ± l, ± 2. ± L. (1,5)
По същия начин се определя и общ момент на въртене системи:
където квантовото число S на получения спинов момент може да бъде цяло или полуцело - в зависимост от броя на частиците - четно или нечетно. Ако номерът н частици дори, тогава S = Ns, Ns - 1,. 0, Където s = 1/2, т.е.в този случай С - цели числа. Например за N = 4 числото S може да бъде равно на 2, 1, 0.
Ако номерът н частици странно, тогава С взема всички полуцели стойности от Ns преди с, Където s = 1/2.Например за н = 5 възможни стойности на S са 5/2, 3/2 и 1/2.
В многоелектронен атом всеки електрон може да се характеризира с орбитални и спинови моменти. Възниква естествен въпрос: какъв е общият механичен момент на атома? Отговорът на този въпрос зависи от това кои моменти си взаимодействат по-силно: орбитални, спинови или спин-орбитални.
Оказва се, че най-важен и разпространен е т.нар нормална комуникация, или Връзка Ressel-Saunders. Тази връзка се състои в това, че орбиталните моменти на електроните си взаимодействат по-силно, отколкото със спиновите моменти. Спиновите моменти се държат по подобен начин. В резултат на това всички орбитални ъглови моменти се добавят към получения орбитален ъглов момент ML, и спин - в получения момент на въртене Г-ЦА. И след това взаимодействие MLи Г-ЦА определя общия момент MJ атом:
където квантовото число J на общия ъглов момент може да има една от следните стойности:
Означава, J ще бъде цяло, ако С цяло число (т.е. с четен брой електрони) или полуцело число, ако S е полуцело число (с нечетен брой електрони). Например:
Този тип връзка обикновено е присъщ на леките и не твърде тежки атоми.
Нормалната комуникация обаче не е единствената възможна. Това е само един екстремен случай на комуникация. Друг екстремен случай е т.нар j-j връзка, когато спин-орбиталното взаимодействие за всеки електрон се оказва основното. В този случай общият момент на атома, т.е., е равен на сумата на отделните моменти на спин-орбита Mj.
Такава връзка се намира в тежките атоми, но доста рядко. По принцип се осъществяват по-сложни междинни видове комуникация.
В случай на нормална връзка, концепцията се въвежда срок на атома, което напълно характеризира енергийното състояние на целия атом като цяло, термините обикновено се обозначават със символи:
(1,8)
Където v = 2S + 1 - множественост, J Е квантовото число на общия момент. Единствената разлика с обозначението, въведено за електрона, е, че малките букви с и j заменени със съответните големи S и J.
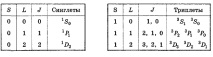
Нека дадем примери за термини за системи с два електрона. Тук са възможни два случая: S = 0 (спиновете на електроните са противоположни) и S = 1 (спиновете са съвместно насочени).
В първия случай J = L и 2S + 1 = 1, т.е. всички членове са единични. Във втория случай 2S + 1 = 3, тоест и трите термина са тризнаци. Горното е обобщено за яснота в таблици 2 и 3.
Таблица 2 Таблица 3
Трябва да се отбележи, че не всички преходи между термини са възможни. Тези преходи трябва да се подчиняват на правилата за подбор. Емпирично е установено, че при нормално свързване в сложни атоми правилата за избор на квантови числа L, S, J са както следва:
В този случай обаче преходът J = 0 → J = 0 забранени.
Тези правила за подбор се основават на квантовата теория и не винаги са достатъчно строги. Припомнете си, че същността на тези правила е, че само при такива промени в квантовите числа L, S, J вероятността от преходи е значителна
- Аксиален момент - Инерция - Технически речник Том I
- ОСЕН МОМЕНТ НА РАЗДЕЛ ИНЕРТИЯ превод от руски на английски, превод руски на английски
- Характеристики на обработка на облицовки и цилиндри
- Механично напрежение
- Невидим фотьойл ще ви позволи да се отпуснете по всяко време