ЛЕКЦИЯ No1
ЛЕКЦИЯ No 1. Идеален газ. Реално уравнение на състоянието на газа
1. Елементи на молекулярно-кинетичната теория
Науката познава четири вида агрегатни състояния на материята: твърдо, течно, газово, плазмена. Призовава се преминаването на вещество от едно състояние в друго фазов преход. Както знаете, водата съществува в три агрегатни състояния: течно (вода), твърдо (лед), газообразно (пара). Тази разлика между трите агрегатни състояния се определя от междумолекулното взаимодействие и степента на конвергенция на молекулите.
Газ - агрегатното състояние на материята, при което молекулите се движат хаотично, разположени на голямо разстояние една от друга. IN твърдо тела, разстоянията между частиците са малки, силата на привличане съответства на силата на отблъскване. Течност - агрегатно състояние, междинно между твърдо и газообразно. В течността частиците са разположени близо една до друга и могат да се движат една спрямо друга; течността, подобно на газа, няма определена форма.
Всяко от тези състояния може да бъде описано чрез набор от някои параметри: например състоянието на даден газ е напълно описано чрез три параметъра: обем, налягане, температура.
Комбинацията от три параметъра, доста лесно измерими, още от средата на 17 век, когато са създадени барометри и термометри, описва добре състоянието на газовата система. Ето защо изучаването на сложни многоатомни системи започва с газове. Р. Бойл е в началото на науките за химия и физика.
2. Уравнение на състоянието на идеалния газ
Изследване на емпиричните газови закони (Р. Бойл, Дж. Гей-Люсак) постепенно доведе до идеята за идеален газ, тъй като беше установено, че налягането на дадена маса на всеки газ при постоянна температура е обратно пропорционално на обема, зает от този газ, а топлинните коефициенти на налягане и обем съвпадат с висока точност за различни газове, което прави, според съвременните данни, 1/273 градуса –1. След като измислих начин за графично представяне на състоянието на газа в координатите "налягане - обем", Б. Клапейрон получи комбиниран закон за газа, свързващ и трите параметъра:
където коефициентът IN зависи от вида на газа и неговата маса.
Само след четиридесет години Д. И. Менделеев даде на това уравнение по-проста форма, записвайки го не за маса, а за единица количество вещество, т.е. 1 kmol.
Където R - универсална газова константа.
Физическото значение на универсалната газова константа. R - разширяването на 1 kmol идеален газ при нагряване с един градус, ако налягането не се промени. Да разберем физическия смисъл R, Нека си представим, че газът е в съд с постоянно налягане и ние увеличаваме температурата му с ?т, тогава
Изваждайки уравнение (2) от (3), получаваме
Ако дясната страна на уравнението е равна на единица, тоест тогава сме загряли газа с една степен
Защото P = F/С, и ?V равна на площта на съда С, умножено по повдигането на неговото бутало ?з, ние имаме
Очевидно вдясно получаваме израз за работата и това потвърждава физическото значение на газовата константа.
3. Кинетична теория на газовете
Концепцията за молекулярната структура на материята се оказа много плодотворна в средата на 19 век. Когато беше приета хипотезата на А. Авогадро, че киломол от което и да е вещество съдържа същия брой структурни единици: 6,02 х 10 26 kmol = 6,02 x 10 23 mol, тъй като моларната маса на водата M (H2O) = 18 kg/kmol, следователно, в 18 литра вода има толкова молекули, колкото в 22,4 m 3 водна пара. Това улеснява разбирането, че разстоянието между молекулите на газообразна вода (пара) е много по-голямо, средно с един порядък, отколкото в течна вода. Може да се приеме, че това е вярно за всяко вещество. Ако приемем, че молекулите се движат хаотично в газове, можем да изведем т.нар основно уравнение на кинетичната теория:
Където Na - 6,02 x 10 26 kmol = 6,02 x 10 23 mol - числото на Авогадро;
VM - молекулен обем = 22,4 m 3;
м - масата на една молекула;
v Е скоростта на молекулата.
Преобразуваме уравнение (4):
Където Ек - енергия на една молекула.
Вижда се, че вдясно е общата кинетична енергия на всички молекули. От друга страна, сравнявайки с уравнението на Менделеев-Клапейрон, виждаме, че този продукт е равен на RT.
Това ни позволява да изразим средната кинетична енергия на газова молекула:
Където k = R/Na - Константата на Болцман, равна на 1,38 ´ 10–23 kJ/kmol. Познавайки кинетичната енергия на молекулата, можете да изчислите средната й скорост
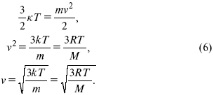
Около 1860г. DC Максуел изведена функция, която описва разпределението на скоростта на газовите молекули. Тази функция изглежда като характерна крива на графиката с максимална близо до най-вероятната скорост от около 500 m/s. Важно е да се отбележи, че има молекули със скорости, надвишаващи този максимум. От друга страна, уравнение (6) ни позволява да заключим, че фракцията на молекулите с високи скорости се увеличава, когато газът се нагрява. Почти 60 години по-късно гениалното предположение на Д. К. Максуел се потвърждава в експерименти О. Стърн.
4. Уравнение на състоянието на реалния газ
Проучванията показват, че уравнението на Менделеев-Клапейрон не е много точно при изучаване на различни газове. Холандски физик J. D. Van der Waals беше първият, който разбра причините за тези отклонения: една от тях е, че поради огромния брой молекули техният собствен обем като цяло е сравним с обема на съда, в който се намира газът. От друга страна, съществуването на взаимодействие между молекулите на газа леко изкривява показанията на манометрите, които обикновено се използват за измерване на налягането на газа. В крайна сметка Ван дер Ваалс получи уравнение от следната форма:
Където и, в - постоянни стойности за различни газове.
Недостатъкът на това уравнение е, че и и в трябва да се измери емпирично за всеки газ. Предимството е, че включва преходен регион газ към течност при високо налягане и ниски температури. Тази реализация позволи да се получи газ в течна фаза.
- Лекции 1 - Основи на роботиката - StudIzba
- Лекция - Движението на Земята около оста и нейните последици
- Лекции по технологии - Фармацевтични технологии
- Лекция 6
- Лекция 4