Рентгенови спектри на атомите
Честотите на излъчване, излъчвано от атомите, са в много широк диапазон от честотите на инфрачервеното излъчване до честотите на рентгеновите лъчи.та радиация. Електромагнитното излъчване на оптичния честотен спектър възниква, когато един от външните (оптични) електрони преминава от възбудено състояние в основно състояние. Квант характерен наемгенното излъчване се ражда, когато електрон преминава в един от вътрешнитевътрешните слоеве на атома, когато има свободно състояние.
Рентгеновите лъчи се генерират в специални рентгенови тръбипри бомбардиране на антикатода с високоенергийни електрони (виж фиг. 17.5). Рентгеново излъчване, генерирано от електрическо спиранетронове в материята, има непрекъснат честотен спектър, който не зависи от материала на антикатода. Когато енергията на антикатодната бомбардировка етронове е достатъчно голям, някои от тях, сблъсквайки се с атоми, избиват електрони от вътрешните им слоеве. След известно време електрон от слой с по-голям радиус преминава на свободното място. По време на такива преходи атомът излъчва кванти рентгеново лъчение, чиито честоти са характерни само за този атом. Спектралните линии на характерното рентгеново лъчение са видими на фона на непрекъснатия спектър на тормозно излъчване (виж фиг. 17.6). Рентгеновите спектри на атомите, за разлика от техните оптични спектри, имат проста структура, която е еднаква за всички атоми. Те се състоят от няколко серии, които са обозначени с букви K, L, M и т.н. Всяка серия не съдържаголям брой линии, посочени в низходящ ред на дължината на вълната чрез индекси α, β, γ, . които пишат в символа на поредицата: Kα, Kβ…, Lα, Lβ, .
Английският физик Хенри Моузли открива през 1913 г. закон, отнасящ се до честотата на която и да е линия от характерното рентгеново лъчениесъс сериен номер Z. атомът, излъчващ това излъчване:
(21,57)
където стойността σ има една и съща стойност за всички редове от една и съща серия, стойността С за всеки ред приема собствена стойност, но за всички атоми еднакво, т.е. независимо от серийния номер. За всички линии от серията K σ = 1, за линии от серия L σ = 7.5 .
Да разгледаме един от електроните на атома, който е в номерирания слой P. Въздействието върху този електрон от други електроново може да се изчисли приблизително, ако вземем предвид, че електронните облаци имат почти сферично симетрична форма. Както знаете от elekтръстика, няма електрическо поле вътре в заредената сфераem, а извън сферата е същото като полето на точков заряд. Следователно само тези електрони ще повлияят на разглеждания електрон.троновете на атома, които са в един слой с него или в слоеве по-малкоширок радиус. Нека броят на такива електрони да бъде σn. Тогава можем да приемем, че разглежданият електрон се движи в кулоновското поле на заряда д ( Z - σn ). В този случай енергията на този електрон, като се вземе предвид формула (21.32), може да бъде представена във формата
(21,58)
Описаните от тази формула нива на електронна енергия са показани на фиг. 21.6.
Формула (21.58) води до следния израз за спектъра настотици характерни рентгенови лъчи:
Ако поставим тук приблизително, тогава стигаме до формулата
(21,59)
който изразява закона на Моузли.
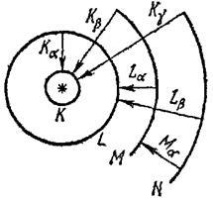
Фигура: 21.6. Диаграма на енергийните нива, съответстващи на различниелектронните слоеве на атома. Стрелките показват преходите на електрическотопрестоли от една държава в друга,
Линия Kα Рентгеновото лъчение се излъчва от атом, когато електрон преминава от L-слоя (н2 = 2) в ДА СЕ-слой(н1 = 1). За честоти Ка-линейна формула (21.59) приема формата
Един прост метод за определяне на поредния номер се основава на закона на Моузлимярка на елемент в периодичната таблица. Така например, чрез измерване на честотата Kα-линията на рентгеново излъчване, излъчвана от някакъв атом, използвайки формулата (21.60), можете да изчислите серийния номер Z. този атом.
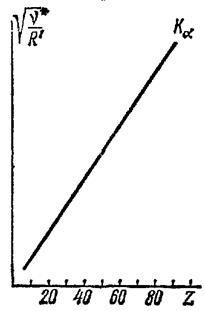
Фигура: Диаграма на Моузли
6. Физическият смисъл на появата на линейни характерни рентгенови спектри беше изяснен в теорията на Бор за атома.
Както видяхме в § 14.5, в атомите с голямо атомно число Z, вътрешните електронни обвивки K, L, M и други са напълно запълнени с електрони. Когато електрон се отстрани от една от вътрешните обвивки, електрон от черупката, по-далеч от ядрото, се прехвърля на свободното място и се излъчва рентгенов фотон. Ако например,
електронът се отстранява от най-вътрешната К-обвивка на атома под действието на електрон, падащ върху атома или първично твърдо излъчване, след което на негово място може да премине електрон от L-, M-, N- черупки и др. Такъв преход е свързан с излъчването на фотони с определена енергия и появата на рентгенови линии от серия К. Очевидно,
че за да се извади електрон от K-обвивката най-близо до ядрото, където електроните изпитват най-голямо привличане към ядрото, е необходим значителен разход на енергия - работата по изваждането на електрон.
Енергията на падащия електрон или първичен падащ фотон трябва да бъде поне равна на тази работа. Следователно за всеки атом има определена граница на възбуждане на К-серията.
Например, за живак (Z-8Q) той е около 82 keV. Преходът на електрон от L-обвивката към K-обвивката съответства на Ka-линията с най-дългата вълна на K-серията от характерни рентгенови лъчи. Линията K $ съответства на прехода на електрон от M-черупката към K-обвивката, K-линията - към прехода от yV-черупката към K-обвивката.
Комбинацията от линиите Ka, K & и Ku образува K-серията. Честотите на линиите се увеличават при преминаване от линиите Ka към Kp и K7. Това се дължи на увеличаване на енергията, освободена по време на прехода на електрон към K-черупката от все по-отдалечени черупки. Напротив,
интензивността на линиите намалява при преминаване от линията Ka към линиите Kk и K7, тъй като вероятността от преходи към черупката K с черупката L \ е по-голяма, отколкото при черупките M, N и
други, по-отдалечени. L, M и др. Серии от характерни рентгенови лъчи
излъчванията се излъчват, когато свободното място за електрона се освободи съответно на L-, M-, N-черупки и т.н. По този начин, когато електрон премине към jL-обвивката, La-линията се появява от M-обвивката, и Lp линията се появява от JV-обвивката и т.н. Всички преходи, завършващи в L-обвивка, съответстват на линиите от L-серията на характерното рентгеново лъчение. Общите закономерности, отбелязани за K-серията, остават валидни за L-серията и т.н.
За серия от характерни спектри е валиден принципът на Ritz Raman, установен за оптични спектри (вж. § 13.3).
На фиг. 14.9 е схематично изображение на появата на различни серии от характерни рентгенови лъчи.
7. H. Moseley, разследващ 1913 г.) зависимостта на дължините на вълните на линията K
22. Молекули
Химична връзка
Нарича се връзката на атомите в молекулите химическа връзка. Почти изцяло се дължи на силите на електростатично взаимодействие междуизчакване с електрони и ядра. Това явление обаче може да бъде обясненоно само с помощта на законите на квантовата механика. Разграничете ковалентен и йонен връзки на атомите в молекулите. Разликите между тези видове комуникация се определят от различни пространствени разпределения.валентни електрони в молекулите. Химичната връзка между два атома се нарича ковалентна, ако вълновата функция, описваща движението на външен електрон, е такава, че може да бъде с еднаква вероятност близо до всеки от тези атоми. В този случай кажетеКазват, че електронът принадлежи на два атома наведнъж. Ковалентната връзка е характерна за молекулите, състоящи се от еднакви атоми. Типичен пример за йонна връзка е връзката между натриевите Na и хлорните атоми C1 в молекулата NaCl. В тази молекула единственият външен електрон на натриевия атом преминава към хлорния атом. В резултат на това се образуват йони Na + и C1 -, между които действат силите на кулоново привличане.
Независимо от естеството на връзката между атомите в молекулата, на големи разстояния (R> Ro) атомите се привличат един към друг, а при малки (R + се образува, когато един електрон се отстрани от молекулата на водорода, т.е. йонът H2 + се състои от три частици: два протона и един електрон (фиг. 22.2)).
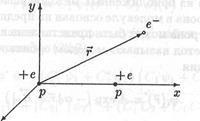
Фигура 22.2 Йон водородни молекули
Уравнението на Шрьодингер за система, съдържаща повече от две частици, не може да бъде решено аналитично. При търсене е близоТова решение отчита факта, че масите на протонните и атомните ядра значително надвишават масата на електрона. Следователно електроните се движатв атомите по-бързо от ядрата. Предполага се, че ядрата се движат по този начиндава се, че за всяко тяхно разположение системата от електрони е в неподвижно състояние.
Стационарно състояние на електрон, движещ се в електрическа посокадва протона се описва от вълновата функция
което е решение на уравнението на Шрьодингер
,
където операторът на общата енергия на електрона
, (22.4)
където операторът на неговата кинетична енергия
- потенциална енергия на взаимодействие на електрон с i -m протон,
i = 12; - радиус вектор на този протон.
Вълновата функция (22.2) трябва да отговаря на условието за нормализиране
(22,5)
В химията обикновено се наричат вълновите функции на електроните в атомите орбитали. Един от приблизителните методи за решаване на уравнението на Шреdinger за електрон в молекула се основава на предположението, че вълнатапървата функция на електрон може да бъде представена като сбор от атомни орбитали. Този метод се нарича орбитален метод.
е вълновата функция, описваща основното състояние на електрона, коятокоето се движи наоколо i -ти протон (i = 1, 2) при условие, че другият
протонът е достатъчно далеч и не влияе на това движение. ДруС други думи, функцията (22.6) е електронната орбитала във водородния атом. Така че функциите ψ1 и ψ2 са решения на уравненията
(22,7)
Където Е.0 = - Rħ - енергията на основното състояние на електрон във водороден атомДа.
Нека да конструираме правоъгълна декартова координатна система, така че оста х преминава през протоните и един от тях е в началото (фиг. 22.2). На фиг. 22.3 показва графики на зависимости от координати х потенциални енергии U1 и U2 електрон и неговите вълнови функции (22.6).
- Лов на патици как да се целите правилно - Оцеляване в дивата природа и екстремност
- Белодробен сарком - иновативно лечение с дендритна ваксина
- Лов на патици, всичко за лов с видео
- Произходът на фамилията Углов
- Произходът на името Шипко