Митоксантрон (Митоксантрон)
Съдържание
Структурна формула
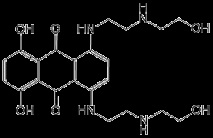
Руско име
Латинско наименование на веществото Mitoxantrone
Химично наименование
1,4-дихидрокси-5,8-бис [[2 - [(2-хидроксиетил) амино] етил] амино] -9,10-антрацендион (като дихидрохлорид)
Брутна формула
Фармакологична група на веществото Митоксантрон
Нозологична класификация (ICD-10)
Характеристики на веществото Mitoxantrone
Митоксантрон хидрохлорид е синтетично производно на антрациклин.
Фармакология
Той е вграден между двойките основи на ДНК, нарушава нейната структура и функция, инхибира синтеза и митозата на РНК (главно в късния етап на S-фазата). Действа както на пролифериращи, така и на непролифериращи клетки. Той бързо прониква в тъканите, малко по-бавно в мозъка и гръбначния мозък, очите. Най-високи концентрации се откриват в щитовидната жлеза, белите дробове, черния дроб, сърцето и еритроцитите. Дозозависим и необратимо (при продължително лечение) инхибира функцията на половите жлези, причинявайки аменорея или азооспермия. Дългосрочната употреба може да насърчи развитието на вторични злокачествени тумори (дългосрочен ефект).
Има мутагенен ефект в бактериалните системи, причинява хромозомни аберации при животни, увреждане на ДНК и обмен на сестрински хроматиди в експерименти инвитро . При експерименти върху зайци той увеличава честотата на преждевременно раждане, при плъхове - забавя образуването на бъбреците и причинява намаляване на телесното тегло на потомството. По този начин при предписването е необходимо да се вземат предвид възможните мутагенни, тератогенни и канцерогенни ефекти.
Свързва се с плазмените протеини със 78%. Екскретира се бавно: T1/2 в плазмата - 2,3-13 дни. Стабилен обем на разпределение 1000 l/m 2. В черния дроб той се окислява и образува производни на моно- и дикарбоксилни киселини. Екскретира се през хепатобилиарната система (25% от дозата се открива във фекалиите 5 дни след IV приложение) и през бъбреците. Средно чернодробната дисфункция (концентрация на билирубин 13–34 mg/l) не е придружена от промяна във фармакокинетичните свойства, по-изразена промяна (концентрация на билирубин над 34 mg/l) води до намаляване на плазмения клирънс и увеличаване на AUC ( необходимо е коригиране на дозата). Екскрецията през бъбреците е ограничена: само 6-11% от дозата се появява в урината след 5 дни прием (65% - непроменено лекарство, 35% - 2 неактивни киселинни метаболити и техните глюкурониди). По-голямата част от дозата се свързва активно в тъканите и се освобождава постепенно, причинявайки тенденция към кумулация. Практически не се отстранява чрез хемодиализа или перитонеална диализа.
Приложение на веществото Mitoxantrone
Рак на гърдата (с регионални или отдалечени метастази); рак на черния дроб, яйчниците, простатната жлеза (включително устойчив на хормони етап IV със синдром на болката); неходжкинови лимфоми; остра миелоидна, промиелоцитна, монобластна левкемия; еритромиелоза при възрастни (с неефективността на традиционните средства), раков асцит.
Противопоказания
Свръхчувствителност, интратекално приложение, бременност, кърмене.
Ограничения за употреба
Оценката на съотношението риск-полза е необходима в следните случаи: левкопения, панцитопения, тежки съпътстващи заболявания, нарушена чернодробна и/или бъбречна функция, подагра, варицела, херпес зостер, предишна цитотоксична или лъчева терапия, старост или детска възраст.
Приложение по време на бременност и кърмене
Противопоказан при бременност.
Категория на действие на FDA - д.
Кърменето трябва да бъде спряно по време на лечението.
Странични ефекти на веществото Mitoxantrone
От нервната система и сетивните органи: главоболие (10%), конвулсии (4%), слабост, умора.
От страна на сърдечно-съдовата система и кръвта (хематопоеза, хемостаза): сърдечна недостатъчност (5%), аритмия (3%), тахикардия, болка в гърдите, преходни промени на ЕКГ, намалена фракция на изтласкване на лявата камера, инфаркт на миокарда, хипотония, флебит, кървене, левкопения, тромбоцитопения, еритроцитопения.
От храносмилателния тракт: загуба на апетит, гадене и повръщане (72%), диария (47%), стоматит (29%), стомашно-чревно кървене (16%), коремна болка (15%), жълтеница (3%), язви в устната кухина и по устните, чернодробна дисфункция (повишени нива на билирубин, промени в активността на AST, ALT), запек.
От страна на кожата: алопеция (37%), гъбични кожни лезии (15%), петехии/екхимотичен обрив (7%), обрив, уртикария, сърбеж.
От дихателната система: грипоподобен синдром (78%), задух (18%), кашлица (13%).
От пикочно-половата система: хиперурикемия, бъбречна недостатъчност, аменорея, азооспермия.
Други: развитие на инфекции - 66% (включително сепсис - 34%, гъбични инфекции - 15%, пневмония - 9%, инфекции на горните дихателни пътища - 7%), треска, алергични реакции (анафилаксия и др.), конюнктивит (5%), дразнене на мястото на инжектиране, некроза на подкожната мастна тъкан (в случай на контакт с кожата и в периваскуларното пространство).
Взаимодействие
Други противоракови и миелотоксични лекарства, пробенецид, сулфинпиразон и лъчева терапия увеличават токсичността. Даунорубицин, доксорубицин и медиастинално облъчване увеличават риска от кардиотоксичност. Урикозуричните лекарства против подагра увеличават вероятността от нефропатия (корекция на дозата е необходима при лечението на хиперурикемия и подагра). НСПВС потенцират страничните ефекти на кръвта (риск от кървене). Отслабва ефективността на имунизацията с инактивирани ваксини; когато се използват ваксини, съдържащи живи вируси, той засилва вирусната репликация и страничните ефекти на ваксинацията (имуносупресивен ефект). Фармацевтично несъвместим с тиамин (причинява разрушаването му), хепарин и с други лекарства в инфузионен разтвор или в същата спринцовка.
Предозиране
Симптоми: тежка депресия на костния мозък (с продължителност до 3 седмици), агранулоцитоза, некротичен тонзилит, инфекциозни лезии на стомашно-чревния тракт, диария, кървене, прояви на кардиотоксичност.
Лечение: хоспитализация, мониторинг на жизнените функции; намаляване на дозата или отнемане на лекарството; симптоматична терапия; ако е необходимо - преливане на кръвни съставки, тромбоцитна и левкоцитна маса, предписване на широкоспектърни антибиотици.
Начин на приложение
IV, IV, интраперитонеално.
Предпазни мерки за митоксантрон
Приложението е възможно само под наблюдението на лекар с опит в химиотерапията. Преди и по време на лечението (на кратки интервали), постоянно наблюдение на клетъчния състав на периферната кръв, определяне на хемоглобин или хематокрит, броя на левкоцитите (общо, диференциално), тромбоцитите, определяне на концентрацията на пикочна киселина, функционални изследвания на сърце, бели дробове, черен дроб, бъбреци. Тежка левкопения се наблюдава в рамките на 10 дни (броят на левкоцитите се възстановява за 3 седмици), възпалението на лигавиците се проявява в рамките на 1 седмица след началото на лечението. Ако имате някой от следните симптоми: панцитопения, студени тръпки, треска, кашлица или пресипналост, болка в долната част на гърба или отстрани, болезнено или затруднено уриниране, кървене или кръвоизлив, черни изпражнения, кръв в урината или изпражненията, незабавно се консултирайте с Вашия лекар. Развитието на неутропения налага внимателно наблюдение, за да се открият навреме признаци на инфекция. Графикът на ваксинацията трябва да се отложи (възможно не по-рано от 3 месеца и до 1 година след завършване на последния курс на химиотерапия), да се изключи контакт с инфекциозни пациенти или да се използват неспецифични превантивни мерки (защитна маска и др.). Други членове на семейството, които живеят с болния, не трябва да бъдат имунизирани с оралната полиомиелит. В случай на тромбоцитопения се препоръчва изключително внимание при извършване на инвазивни процедури, редовно изследване на местата за интравенозно инжектиране, кожата и лигавиците (за откриване на признаци на кървене), контрол на нивата в кръвта в урината, повръщането и изпражненията. Такива пациенти трябва да внимават да се бръснат, да правят маникюр, да мият зъбите си, да използват зъбна нишка и клечки за зъби, да избягват падания и други наранявания, алкохол и ацетилсалицилова киселина, които увеличават риска от стомашно-чревно кървене. Допълнителен курс на лечение е възможен след изчезването на хематотоксичните ефекти. При кумулативни дози над 140 mg/m2 или 100 mg/m2 при пациенти с рискови фактори (медиастинално облъчване, анамнеза за сърдечни заболявания, предишно лечение с антрациклини), рискът от кардиотоксичност се увеличава. Нефропатията на пикочната киселина може да бъде предотвратена с достатъчен прием на течности, алопуринол или алкализиране на урината. Безопасността и ефикасността на употреба при деца не са установени, така че трябва да се въздържате от предписване в детска възраст. По време на лечението е необходимо да се използват адекватни контрацептивни мерки. Пациентът трябва да бъде предупреден за възможната опасност за плода, ако настъпи бременност по време на лечението. В случай на контакт на лекарството с кожата или лигавиците, е необходимо старателно да се изплакне с вода (лигавици) или вода и сапун (кожа). Ако по време на интравенозно инжектиране или инфузия възникне екстравазат, приложението трябва да се прекрати и да се възобнови в друга вена.
специални инструкции
След 1-2 дни е възможно синьо-зелено оцветяване на урината, в редки случаи - обратимо синьо оцветяване на склерата, вените и паравенозните тъкани, ноктите (вероятно е отделяне на нокътните плочи). За интравенозно приложение концентратът на митоксантрон хидрохлорид трябва предварително да се разрежда с 0,9% разтвор на натриев хлорид или 5% разтвор на декстроза. Разтварянето, разреждането и приложението на лекарството се извършва от обучен медицински персонал при спазване на защитни мерки (ръкавици, маски, облекло и др.).
- Medocef - инструкции за употреба, описание, аналози
- NAKLOF, капки за очи - инструкции за употреба, рецензии, описания, аналози
- Naklof - инструкции за употреба, описание, аналози
- Крем Demoten инструкции за употреба, цена, ревюта, описание
- Мифегин (таблетки) - инструкции за употреба, приложение, показания, противопоказания, действие,