Микроскопски методи
Извършване на постоянни препарати (допълнителен материал - за информация и за справка)
1. Фиксиране. Фиксирането е запазване на материала в състояние, близко до естественото. Това изисква бързо умъртвяване на тъканта, което се постига най-добре с малки парченца жив материал. Веществото, използвано за това, се нарича фиксатор. Бързото фиксиране постига запазване на оригиналната структура на обекта и тъканите се уплътняват толкова много, че от тях могат да се приготвят тънки срезове.
2 дехидратация.Дехидратацията се извършва при подготовка на материала за изливане или за затварянето му в подходяща среда (виж по-долу), която не се смесва с вода. Водата също трябва да бъде отстранена, защото в противен случай лекарството в крайна сметка ще бъде унищожено от бактерии. За за да се запази ултраструктурата, дехидратацията трябва да се извършва постепенно, като материалът се обработва с поредица от водни разтвори на етанол или ацетон с постоянно нарастваща концентрация и завършва обработката с "абсолютен" (безводен) етанол или пропаноп.
3 просветление. Някои от често използваните наливни и покриващи среди не се смесват с алкохол. Следователно тя трябва постепенно да се замени със среда (антирефлексно средство), с която се смесва пълнещата среда, например ксилол. Това също кара материала да стане прозрачен.
4. Попълване. За да се получи много тънък участък с помощта на микротом, е необходимо материалът да се излее в подходяща носителна среда. Когато се подготвят препарати за светлинна микроскопия, предметите се влагат в парафин, който след това се оставя да се охлади. За електронна микроскопия е необходимо да се използват по-твърди вещества (пластмаси или смоли), тъй като тук са необходими особено тънки участъци, което означава, че опората трябва да е по-плътна.
5 правене на филийки. Обикновено парчетата материал са твърде дебели, за да могат да преминат достатъчно светлина през тях за изследване под микроскоп. Обикновено е необходимо да се отреже много тънък слой от тестовия материал, тоест да се подготвят секциите. Разрезите могат да бъдат направени със скалпел, самобръсначка или микротом. Разфасовките се приготвят ръчно с помощта на заточена самобръсначка. За да работите върху конвенционален микроскоп, секциите трябва да са с дебелина 8-12 микрона. Тъканта е закрепена между две парчета сърцевина от бъз. Възможно е да се използват филийки плътни моркови. Самобръсначката се навлажнява с течността, в която се е съхранявала тъканта; прави се разрез през бъз (морков) и кърпа, а самобръсначката се държи хоризонтално и се придвижва към вас с бавно плъзгащо движение, насочено леко наклонено. След като бързо направихте няколко секции, трябва да изберете най-тънкия, съдържащ характерни тъканни области.
Разрез от тъкан, вградена в определена среда, може да се направи с помощта на микротом. За лек микроскоп, парчета с дебелина няколко микрометра могат да бъдат направени с вградена в парафин тъкан с помощта на специален стоманен нож. На ултратом за електронен микроскоп се правят изключително тънки срезове (20-100 nm). В този случай е необходим диамантен или стъклен нож.
6. Боядисване. По правило биологичните структури на препаратите са прозрачни; следователно, за да се получи контраст между тях, трябва да се прибегне до различни средства. Най-често срещаното е оцветяването. Някои багрила, използвани при светлинна микроскопия, са изброени в таблицата по-долу.
Някои багрила в ниски концентрации не са токсични за живите тъкани и поради това могат да се използват за оцветяване на жив материал. Те се наричат жизненоважни (жизненоважни) багрила. Те включват например метиленово синьо и неутрално червено.
Когато се оцветяват парафиновите секции, парафинът се отстранява с разтворител и участъкът се напоява частично.
7. Заключение. Напълно оцветените секции са затворени на предметно стъкло в специална среда, например в канадски балсам или еупарол. Тази среда не позволява на въздуха да премине, така че разрезът да може да се съхранява в нея за неопределено време. Покрийте филийката в средата с фиш за покритие.
Последователността на стъпките, описана по-горе, е типична, когато става въпрос за подготовка на тънки филийки за постоянни препарати. Въпреки това, в процедурата често се правят следните две промени:
а) ако разрезът на суровината се приготвя ръчно, тогава разрезът първо се прави и след това се фиксира;
б) възможно е оцветяване след фиксиране или в процес на дехидратация на всеки етап. Например, багрило, разтворено в 50% етанол, може да се използва за оцветяване на участък, след като е дехидратирано в 50% етанол.
Описаната процедура за приготвяне по същество е еднаква както за светлинния, така и за електронния микроскоп, въпреки че има някои разлики в детайлите (те са изброени в таблицата).
Временни наркотици
Временните препарати за светлинен микроскоп, за разлика от постоянните, могат да бъдат направени относително бързо. Те са подходящи за бързо предварително проучване. Материалът за това е фиксиран, боядисан и затворен в определена среда. Резените могат да се приготвят преди фиксиране или мацерация (дървото например се мацерира).
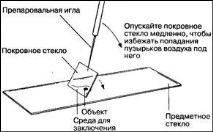
2. Различни временни петна могат да се използват за оцветяване и покриване. Всяка секция трябва да се постави върху чиста стъклена пързалка (предварително изтрита с алкохол) и върху нея да се капнат няколко капки багрило. Когато оцветявате с флороглюцинол, добавете една капка концентрирана солна киселина.
3. След това образецът се покрива с тънко покривно стъкло, за да се предотврати навлизането на въздух и прах и да се предпази лещата с голямо увеличение от замърсяване.
4. Ако пробата започне да изсъхва или ако предварително се знае, че ще е необходимо продължително проучване (повече от 10 минути), след оцветяването препаратът трябва да бъде затворен в глицерол.
Фракциониране на клетките
Когато става въпрос за идентифициране на функциите на отделна органела, са необходими допълнителни изследователски методи. Обикновено за това трябва да го отделите от другите клетъчни компоненти и да го накарате да изпълнява функцията си in vitro.
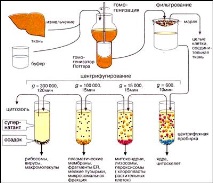
За да се изолират клетъчните органели, пробата за изпитване се натрошава и след това хомогенизира,като ги поставите в подходяща среда (буферен разтвор) с правилното pH, йонния състав и температурата. За изолирането на непокътнати органели е изключително важно средата, в която се извършва хомогенизацията, да бъде изотонична, тези. осмотичното налягане на буферния разтвор трябва да съвпада с налягането вътре в клетката. Ако разтворът е хипотоничен, органелите ще „абсорбират“ допълнително вода и ще се пръснат, докато при хипертоничните разтвори, напротив, те се свиват. Хомогенизирането обикновено се извършва с помощта на хомогенизатор Potter-Elwedge (тефлонов пестик, въртящ се в стъклен цилиндър), но може да се направи и с конвенционален миксер.
Хомогенизацията е последвана от филтрациячрез марля за отстраняване на останалите клетки и влакна на съединителната тъкан.
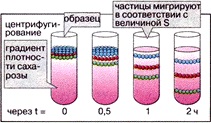
Частиците в разтворите се утаяват, когато тяхната плътност е по-висока от плътността на разтвора (утаяване), остават неподвижни, ако плътностите на частиците и разтвора са еднакви, или плуват, когато плътността им е по-ниска от плътността на разтвора (флотация). Колкото по-голяма е разликата в плътността, толкова по-бързо протича разпределението на частиците (снимка вдясно).
Макромолекулите или органелите, които се различават леко по размер или плътност, могат да бъдат разделени само чрез центрофугиране в разтвор с определена плътност.
Центробежната сила, генерирана в центрофуга, обикновено се изразява като кратно на ускорението поради гравитацията g (g = 9,81 m/s 2). Стойности до 10 000 g се получават с обикновена настолна центрофуга, високоскоростните хладилни центрофуги достигат 50 000 g, а стационарните хладилни и вакуумни ултрацентрифуги достигат 500 000 g.
Скоростта на утаяване на частицата (V) зависи от ъгловата скорост на въртене на ротора (ω), ефективния радиус на ротора (rff е разстоянието от оста на въртене) и коефициент на утаяване частици, изразени в Swedberg (S).
Коефициент на утаяване на частиците - скоростта на неговото слягане при референтните стойности на буферната плътност, ъгловата скорост на ротора и неговия ефективен радиус.
Да вземем две оловни пелети с еднаква маса и да изравним едната с чук до относително тънко фолио. Какво се промени? Масата остава същата, плътността на оловото при дадена температура е постоянна. Въпреки това, във вискозна течност, сплескана пелета ще се утаи по-бавно от кръгла пелета. При промяна на формата площта на повърхността се увеличава, което води до увеличаване на силата на триене.
Колкото по-голям е броят на оборотите на центрофугата, толкова по-фини частици се отлагат. Центрофугирането се извършва на няколко стъпки, като постепенно се увеличава скоростта. След всяко центрофугиране супернатантата (супернатантата) се отделя от утайката, за да се подложи отново на центрофугиране. Всяка следваща утайка съдържа все по-малки и по-малки органели. Тази техника е известна като диференциално центрофугиране.
Последователността и условията на утаяване на различни органели по време на диференциално центрофугиране са показани на диаграмата вдясно.
Изолирането на клетъчните органели обикновено се извършва при ниски температури (0-5 ° C), за да се намали степента на разграждане на материала поради реакции, катализирани от ензими; последните се освобождават при разрушаване на тъканите.
Допълнителен (справочен) материал
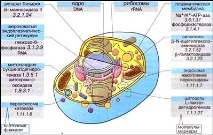
По време на процеса на фракциониране е важно да се контролира чистотата на фракциите. Присъствието в определена фракция на определена органела и присъствието на други компоненти се определят с помощта на маркери молекули. Обикновено това са ензими, специфични за даден органоид (маркери ензими). Разпределението на маркерните ензими в клетката отразява локализацията на съответните каталитични реакции в нея.
Метод за проследяване.
Методът на белязаните атоми се използва при изследване на биохимичните процеси в живите клетки. За да се проследят трансформациите на дадено вещество, един от атомите в неговия предшественик се заменя със съответния радиоактивен изотоп (3 H, 32 P, 14 C и др.).
Както знаете, химичните свойства на изотопите на един и същи елемент не се различават един от друг, но радиоактивният изотоп сигнализира за местоположението му с радиоактивно излъчване. Това дава възможност да се проследи определено съединение, да се установи последователността на етапите на химичните му трансформации, тяхната продължителност във времето, зависимост от условията и т.н.
Живите клетки често се наблюдават на ултравиолетова светлина. В този случай някои клетъчни компоненти веднага започват да светят (флуоресцират), докато други светят само когато се добавят специални багрила. Флуоресцентната микроскопия ви позволява да видите местоположението на нуклеиновите киселини, витамините, мазнините и т.н.
Разнообразие от форми на живот на клетъчно ниво (предварително запознаване).
Органичният свят се отличава с изключително разнообразие от форми. Според нивото на организация всички организми често се разделят на две групи: вируси („предклетъчни“ и защо в кавички - виж по-долу) и клетъчни. Изследването на клетките на различни организми показа, че по своята структура те се разделят на две групи - прокариоти и еукариоти.
Групата на прокариотите е съставена от архебактерии и еубактерии (включително цианид). Тези организми имат най-простата клетъчна структура: нямат оформено ядро и много органели (структурни компоненти на цитоплазмата).
Друга група се състои от всички други организми: гъби, растения, животни (включително хора). Те имат сложни клетки, наречени еукариотни клетки. Тези клетки имат ядро и органели, които изпълняват специфични функции. Към днешна дата са проучени над 3000 вида вируси, около 4000 вида прокариоти и над 2 милиона вида еукариоти.
- Лагер край морето в България Лечение на сколиоза по метода на Катарина Шрот, Лечение в България
- Коклюш при деца, симптоми, лечение, алтернативни методи
- Нискотемпературен химичен метод за получаване на фулерен
- ПОРЪЧАЙТЕ MREO като бизнес ценообразуване и методи (опит в Криви Рог)
- Майсторски клас по темата Ефективни техники и методи на преподаване на математика в специална корекция