Метанови въглеводороди
Алканите са наситени съединения и съдържат възможно най-много водородни атоми. Всеки въглероден атом в алкановите молекули е в състояние на sp³ хибридизация. Най-простият представител на класа е метанът (CH4).
Съдържание
Номенклатура

Рационално
Избран е един от атомите на въглеродната верига, счита се, че е заместен с метан и името алкил1алкил2алкил3алкил4метан е конструирано спрямо него, например:
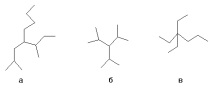
а-н-бутил-сек-бутил-изобутилметан b- триизопропилметан с- триетил-пропилметан
Систематичен IUPAC
Според номенклатурата на IUPAC имената на алканите се образуват с помощта на наставката -an чрез добавяне към съответния корен от името на въглеводорода. Най-дългата неразклонена въглеводородна верига е избрана така, че най-големият брой заместители да има минималния брой във веригата. В името на съединението число показва номера на въглеродния атом, в който се намира заместителният радикал, след това името на радикала и името на основната верига. Ако радикалите се повтарят, те изброяват числата, указващи тяхната позиция, а броят на еднакви радикали се обозначава с представки di-, tri-, tetra-. Ако радикалите не са еднакви, тогава имената им са изброени по азбучен ред. Например:
Хомоложни серии и изомерия
Изомеризмът на наситените въглеводороди се дължи на най-простия тип структурна изомерия - изомеризъм на въглеродния скелет. Алканите с повече от три въглеродни атома имат изомери. Броят на тези изомери се увеличава с огромна скорост, тъй като броят на въглеродните атоми се увеличава. За алкани с н = 1.12 броят на изомерите е 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
Физически свойства
- Точките на топене и кипене се увеличават с молекулното тегло и дължината на въглеродния скелет
- При нормални условия алканите от СН4 до С4Н10 са газове; от C5H12 до C17H36 - течности. А след C18H38 - твърди вещества.
- Точките на топене и кипене намаляват от по-слабо разклонени до по-разклонени. Например, при нормални условия н-пентанът е течен, а неопентанът е газ.
Спектрални свойства
IR спектроскопия
В IR спектрите на алканите ясно се проявяват честотите на разтягащи се вибрации на СН връзката в областта от 2850-3000 cm -1. Честотите на разтягащите вибрации на С-С връзката са променливи и често с ниска интензивност. Характерните огъващи вибрации в СН връзката в метиловата и метиленовата групи обикновено са в диапазона 1400-1470 cm -1, но метиловата група дава слаба лента в спектрите при 1380 cm -1 .
UV спектроскопия
Чистите алкани не абсорбират в ултравиолетовия диапазон над 2000 Å и поради тази причина те често са отлични разтворители за вземане на UV спектри на други съединения.
ЯМР спектроскопия
Масова спектрометрия
Химични свойства
Алканите имат ниска реактивност. Това се дължи на факта, че единичните връзки C-H и C-C са относително здрави и трудни за разрушаване.
Основното химично свойство на наситените въглеводороди, което определя тяхното използване като гориво, е реакцията на горене. Пример:
В случай на липса на кислород, вместо въглероден диоксид се получава въглероден окис или въглища (в зависимост от липсата на кислород)
В общия случай уравнението на реакцията на горене за всеки въглеводород CxHy може да бъде написано, както следва:
Халогениране
Халогенирането на алкани протича по радикален механизъм. За да се инициира реакцията, е необходимо да се облъчи смес от алкан и халоген с UV светлина или топлина. Хлорирането на метана не спира на етапа на получаване на метилхлорид (ако се приемат еквимоларни количества хлор и метан), а води до образуването на всички възможни заместителни продукти, от метил хлорид до въглероден тетрахлорид. Хлорирането на други алкани води до смес от продукти на заместване на водорода при различни въглеродни атоми. Съотношението на хлориращия продукт зависи от температурата. Скоростта на хлориране на първичните, вторичните и третичните атоми зависи от температурата; при ниски температури скоростта намалява в серията: третична, вторична, първична. С повишаване на температурата разликата между скоростите намалява, докато не стане същата. В допълнение към кинетичния фактор, разпределението на хлориращите продукти се влияе от статистически фактор: вероятността от атака на хлор върху третичен въглероден атом е 3 пъти по-малка от тази на първичния и два пъти по-малка от тази на вторичния . По този начин хлорирането на алкани е нестереоселективна реакция, с изключение на случаите, когато е възможен само един монохлориращ продукт.
Бромирането на алкани се различава от хлорирането с по-висока стереоселективност поради по-голямата разлика в скоростта на бромиране на третични, вторични и първични въглеродни атоми при ниски температури.
Йодиране на алкани с йод не се случва, производството на йодиди чрез директно йодиране не може да се извърши.
С флуора реакцията протича експлозивно (като правило флуорът се разрежда с азот или разтворител).
Нитрация
Алканите реагират с азотна киселина или N2O4 в газовата фаза с образуването на нитропроизводни: RH + HNO3 = RNO2 + H2O Всички налични данни показват механизъм на свободните радикали. В резултат на реакцията се образуват смеси от продукти.
За метан: CH4 → С + 2H2 - при 1000 ° C
Основният източник на алкани (както и други въглеводороди) са нефтът и природният газ, които обикновено се срещат заедно.
Възстановяване на алкохоли
Редукцията на алкохоли води до образуването на въглеводороди, съдържащи същия брой атоми С. Например, редукционната реакция на бутанол (C4H9OH) протича в присъствието на LiAlH4. Това произвежда вода.
Редукция на карбонилни съединения
Хидрогениране на ненаситени въглеводороди
Синтез на Колбе
По време на електролизата на солите на карбоксилната киселина киселинният анион - RCOO - се премества към анода и там, дарявайки електрон, се превръща в нестабилен радикал RCOO •, който веднага се декарбоксилира. Радикалът R • се стабилизира чрез удвояване с подобен радикал и се образува R - R. Например:
Газификация на твърдо гориво
Провежда се при повишена температура и налягане. Ni катализатор:
Реакция на Вюрц
2R-Br + 2Na = R-R + 2NaBr
реакцията протича в THF при температура -80 ° C.
когато R и R` взаимодействат, може да се образува смес от продукти (R-R, R`-R`, R-R`)
Синтез на Фишер-Тропш
Биологично действие
Те имат наркотичен ефект, който се увеличава с броя на въглеродните атоми. При хронично действие се нарушава нервната система, която се проявява под формата на безсъние, брадикардия, повишена умора и функционални неврози.
- Неметанови въглеводороди - Голяма енциклопедия на нефт и газ, статия, страница 1
- Метанови въглеводороди - Наръчник на химика 21
- Малките кучета са идеалният приятел на човека - Статии за кучета
- Мозъците във вана са
- Кубан 24 - 7 хапливи насекоми от Кубан