Историята на развитието на теорията за структурата на атома
Понятието "атом" (неделимо) е въведено от древногръцките философи през годините 500-200. Пр.н.е. да опише структурата на околния свят. До края на 19 век се смяташе, че атомът е най-простата неделима частица. Първите предположения за сложността на структурата на атома се появяват при изследване на радиоактивността, електрохимичните процеси, катодните лъчи и други явления. По-късно беше установено, че радиоактивността е поток от частици: α - He 2+ ядра, β - електрони и γ - рентгенови лъчи.
12.1.1 Модел на атома на Ръдърфорд
Е. Ръдърфорд през 1911-1913 изследва преминаването на α-частици през метално (златно) фолио. Същността на експеримента е показана на фигура 12.1.
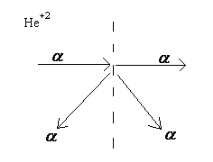
Фигура 12.1 - Преминаване на α-частици през фолиото
Оказа се, че повечето от α-частиците (двойно йонизиран хелий He +2 атом) преминават през фолиото и не се отклоняват, а само малка част променя посоката и дори е хвърляна в обратната посока. Въз основа на това беше направено заключението, че в много малка част от обема на атома има положително заредена частица с голяма маса, сблъсквайки се с която α-частицата е променила посоката си на движение.
Въз основа на получените експериментални данни Е. Ръдърфорд предложи модел на атома, според който атомът се състои от положително заредено ядро, заемащо малък обем, в който е концентрирана по-голямата част от атома, и отрицателно заредени леки частици - електрони. Такава система може да бъде стабилна, при условие че електроните се въртят около ядрото и центробежната сила на въртенето на електроните трябва да бъде равна на електростатичното привличане на електрони към ядрото. Такъв модел, по аналогия със Слънчевата система, беше наречен планетарен.
Въпреки недостатъците, моделът на Ръдърфорд за атома първо дава правилна представа за общата структура на атома, но тя не може да обясни следното:
1) стабилност на ядрото - електронна система. Когато се движи около ядрото, електронът трябва непрекъснато да излъчва енергия, което ще доведе до намаляване на радиуса на орбитата на електрона и в крайна сметка електронът трябва да падне върху ядрото. Всъщност при липса на външно влияние атомът не излъчва енергия;
2) управляваната природа на атомния спектър. Съгласно предложения модел радиусът на електронната орбита трябва непрекъснато да намалява, което трябва да доведе до непрекъснат спектър. Но изследването на спектрите на атомите показа, че те имат линейна природа. Този факт показва, че електроните излъчват и абсорбират енергия не непрекъснато, а на отделни порции ("кванти").
Датският физик Нилс Бор успя да премахне тези противоречия.
Моделът на атома на Бор
През 1900 г. Макс Планк показва, че енергията на електромагнитното излъчване във видимата част на спектъра се квантува, т.е. светлината се излъчва и абсорбира не непрекъснато, а на отделни порции - kwanтами. Енергията на квантите (E) е свързана с честотата на излъчване (υ) в следната формалой:
където h е константата на Планк.
Въз основа на квантовата теория на излуЧения, Нилс Бор стигна до заключението, че електронът в атома може да приема не всякакви, а строго определени енергийни стойности. Преходът на електрон от едно енергийно ниво към друго е придружен от емисиятачрез поглъщане или поглъщане на определен квант електромагнитно излъчване.
Въз основа на квантовата теория на радиацията и планетарния модел на атома според Ръдърфорд, Бор предложи модел на атома, който се основава на следните постулати:
1) електрон в атом може да се върти около ядрото не по никоя, а само по строго определени орбити, които се наричат неподвижни;
2) движейки се по неподвижни орбити, електронът не излъчва енергия;
3) при преминаване от по-ниска към по-висока орбита електронът поглъща енергия, равна на енергийната разлика между съответните орбити. Това състояние на електрона се нарича възбудено. Той остава в това състояние за около 10 -8 секунди и след излъчване на излишна енергия се връща към стационарна орбита.
Информация за състоянието на електроните в атома се предоставя от спектрите на електронните преходи, които в зависимост от метода на изследване се разделят на абсорбционни и емисионни спектри (емисионен спектър). Образно казано, можем да кажем, че спектърът е огледало на електронни състояния. Математическият апарат, предложен от Бор, даде възможност да се изчисли спектърът само на водородния атом и водород-подобни атоми.
Основните недостатъци на модела на атома на Бор:
1) моделът беше неприложим за описание на спектрите на атоми, по-сложни от водорода;
2) моделът не може да обясни различните интензитети на спектралните линии в спектъра дори на водороден атом.
12.2 Съвременни представи за строежа на атома
През 1924 г. Луи дьо Бройл предполага, че всички движещи се частици материал, включително електроните, трябва да имат вълнови свойства.
Комбинирайки уравненията на М. Планк (E = h ν) и А. Айнщайн (E = mc 2), той извежда уравнение за изчисляване на дължината на радиационната вълна на всяка движеща се частица
където h е константата на Планк,
m е масата на частицата, V е скоростта на нейното движение.
До 1927 г. вълновите свойства на електрона са експериментално потвърдени (дифракция и интерференция на електроните). Тоест, за да се опише състоянието на електрон в атом, е необходимо да се вземат предвид неговите вълнови свойства. Следователно можем да говорим за вероятността да намерим електрон в определена област от пространството. С оглед на това терминът "орбита" е заменен с термина "орбитален".
Орбитална - гранична повърхност, в която вероятността за намиране на електрон е 90%.
През 1925 г. австрийският физик Шрьодингер предлага да се използва математическо уравнение (уравнение на Шрьодингер), за да се опише състоянието на електрона в атома, като се вземат предвид вълновите свойства на електрона. Това уравнение е приложимо за описване на електронната структура в атом на всеки елемент. Решението на това уравнение показва, че състоянието на електрон в атом може да бъде описано с помощта на четири квантови числа: главни, орбитални, магнитни и спинови.
Основното квантово число (n) характеризира радиуса и енергията на електрона на енергийно ниво. Може да приема целочислени стойностиния: 1, 2, 3, 4 и т.н. Колкото по-голямо е n, толкова по-голям е радиусът и енергията на електрона.
Орбитално квантово число (l) характеризира енергията на електрона на подниво и формата на електронния облак. Той приема целочислени стойности от 0 до (n - 1). Например, ако основното квантово число n = 4, тогава орбиталното квантово число може да приеме стойностите: 0; един; 2; 3. Тези стойности имат съответно буквени обозначения: s-, p-, d- и f-електронни облаци.
Магнитно квантово число (m) показва броя на орбиталите на поднивото и приема целочислени стойности от –1 до + l (общо 2л + 1 стойности). На s-, p-, d- и f-поднива съответно има 1, 3, 5 и 7 орбитали.
Спиновото квантово число (ms) характеризира правилното движение на електрон и може да приеме две стойности: +1/2 и –1/2, т.е.може да има два електрона в една орбитала.
Принципите на запълване на електронните обвивки на атомите:
принципът на енергийния минимум - запълването на орбиталите става в реда на увеличаване на енергията;
Принципът на Паули - в атомът не може да има два електрона, в които и четирите квантови числа са еднакви;
Правилото на Хунд - въртенето в поднивото трябва да бъде максимално.
Таблица 12.1 показва стойностите на четирите квантови числа и максималния брой орбитали и електрони на енергийни нива и поднива.
Таблица 12.1 - Стойности на n, l, m, броя на орбиталите на поднива
(2l + 1), електрони на поднива (Nl) и нива (Nn)
За описание на състоянието на електроните в атома се използват: електронна формула, енергийна диаграма, геометричен модел.
Електронна формула показва разпределението на електроните по
енергийни нива и поднива. Например:
- за кислород (O) на елемент със сериен номер 8 - 1s 2 2s 2 2p 4,
- за хром (Cr) елемент със сериен номер 24 - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s 2, като се вземе предвид приплъзването на електрона, електронната формула има формата 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1. Електронното приплъзване се обяснява с факта, че половината или изцяло запълнени поднива (p 3, p 6, d 5, d 10, f 7, f 14) се характеризират с повишена стабилност.
Енергийна диаграма графично показва разпределението на електроните в енергийните клетки (орбитали). Стрелката обикновено означава електрон и неговото въртене. Фигура 12.2 показва енергийната диаграма на кислородния атом.
Фигура 12.2 - Енергийна диаграма на кислородния атом
Геометричен модел показва формата на орбиталите и тяхното местоположение в пространството. Фигура 12.3 показва геометричния модел на кислородния атом.
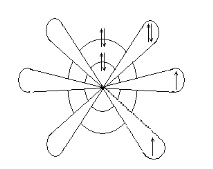
Фигура 12.3 - Геометричен модел на кислородния атом
Електронната формула на елемент може да бъде написана въз основа на позицията му в периодичната таблица, тъй като честотата на промени в свойствата на елементите в таблицата е следствие от периодичността на запълване на енергийните нива и поднивата на атомите с електрони.
Периодичен закон и периодична система на Д.И. Менделеев
DI. Менделеев, сравнявайки промяната в атомните маси на елементите и техните химични свойства, открива периодичния закон:
„Свойствата на простите тела, както и формите и свойствата на съединенията на елементите периодично зависят от стойността на атомните тегла на елементите“.
В съответствие със съвременните представи за структурата на атомите, основната характеристика на всеки елемент е зарядът на неговото ядро, поради което съвременната формулировка на периодичния закон е следната:
„Свойствата на елементите, както и свойствата и формата на съединенията, които образуват, периодично зависят от зарядите на ядрата на техните атоми“.
Отражение на периодичния закон е периодичната система от елементи, която Д. И. Менделеев съставя през 1869 г. Тя включва периоди и групи.
месечен цикъл - хоризонтален ред от елементи. Периодичната таблица има седем периода. f-елементите (лантаниди и актиноиди) са показани като два отделни реда. С периоди радиусите на атомите намаляват.
Група - вертикален ред от елементи. Групите са разделени на основни и вторични подгрупи. За елементите на основните подгрупи се запълва външното енергийно ниво, а за вторичните - пред-външното. Метали и неметали са разположени в основните подгрупи, а само метали във вторичните. Попълването на страничните подгрупи започва от четвъртия период. В основните подгрупи радиусите на атомите се увеличават. В страничните подгрупи, в съответствие с запълването на d- и f-поднивата, се увеличава електростатичното привличане на електрони към ядрото, в резултат на което радиусите на атомите могат дори да намалят. Това явление се нарича d- и f (лантаноидно) компресиране. Това води до намаляване на редуциращата активност и увеличаване на плътността на веществото. Например за подгрупата на медта (Cu, Ag и Au) плътностите на тези метали имат съответно стойности: 8,96, 10,50 и 19,3 g cm 3 .
Елементите, разположени в една подгрупа, имат сходни химични свойства и се наричат аналогови елементи. Например:
O, S, Se, Te, Po - са разположени в VI основната подгрупа и съответно са аналогични елементи;
Cr, Mo, W - разположени в VI страничната подгрупа и също са аналогични елементи.
За характеризиране на химичните свойства на атомите се използват величини като енергия на йонизация, енергия на афинитет на електроните и електроотрицателност. .
Йонизационна енергия - това е количеството енергия, необходимо за отделяне на електрон от невъзбуден атом или йон. Втората и следващите йонизационни енергии са отделянето на електроните от положително заредените йони. Йонизационната енергия определя редуциращите свойства на елементите.
Електронна афинитетна енергия - е количеството енергия, освободено или погълнато, когато електрон се прикрепи към неутрален атом. Колкото по-голяма е енергията на афинитета на атома към електрон, толкова по-силен окислител е този елемент. Металите нямат афинитет към електроните.
Електроотрицателност (EO) - това е стойност, която отчита
способността на атомите както да привличат, така и да отдават електрони. Относителната електроотрицателност на лития се приемаше конвенционално за равна на единица и по отношение на нея бяха открити електроотрицателността на останалите елементи. При преминаване от най-малко електроотрицателния елемент - Fr към най-електроотрицателния елемент - F, електроотрицателността се увеличава и съответно металните свойства се отслабват и неметалните свойства се подобряват. Счита се, че 22 елемента са неметали, а останалите са метали.
В периодичната таблица, в периоди и групи, свойствата на елементите се променят естествено, така че свойствата на всеки елемент са близки до средните аритметични стойности на свойствата на елементите, между които се намира анализираният елемент.
- Как се развива теорията за структурата на атома - Презентация 12982-2
- Пчеларско списание - Историята на развитието на кошер за пчели
- Историята на развитието на системата "интелигентен дом"
- Историята на развитието на ботаническите градини
- Името Садагат - Значението и тайната на името Садагат разберете какво означава името, каква е неговата история