Училищна енциклопедия
Търсене на навигационен изглед
форма за влизане
Перфектен газ. Уравнение за идеален газ. Изопроцеси

Газът е едно от четирите агрегатни състояния, в които материята може да бъде.
Частиците, които изграждат газа, са много подвижни. Те се движат почти свободно и хаотично, като периодично се сблъскват помежду си като билярдни топки. Такъв сблъсък се нарича еластичен сблъсък. По време на сблъсък те рязко променят характера на движението си.
Тъй като в газообразните вещества разстоянието между молекулите, атомите и йоните е много по-голямо от техния размер, тези частици взаимодействат помежду си много слабо и потенциалната им енергия на взаимодействие е много малка в сравнение с кинетичната.
Връзките между молекулите в реалния газ са сложни. Следователно е също доста трудно да се опише зависимостта на нейната температура, налягане, обем от свойствата на самите молекули, техния брой и скоростта на тяхното движение. Но задачата е значително опростена, ако вместо истински газ разгледаме неговия математически модел - идеален газ.
Предполага се, че в модела на идеалния газ няма сили на привличане и отблъскване между молекулите. Всички те се движат независимо един от друг. И към всеки от тях можете да приложите законите на класическата механика на Нютон. И те взаимодействат помежду си само по време на еластични сблъсъци. Времето на самия сблъсък е много кратко в сравнение с времето между сблъсъците.
Класически идеален газ
Нека се опитаме да си представим молекулите на идеалния газ като малки топчета, разположени в огромен куб на голямо разстояние една от друга. Поради това разстояние те не могат да взаимодействат помежду си. Следователно тяхната потенциална енергия е нула. Но тези топки се движат с голяма скорост. Това означава, че имат кинетична енергия. Когато се сблъскат помежду си и със стените на куба, те се държат като топки, тоест отскачат еластично. В същото време те променят посоката на движението си, но не променят скоростта си. Ето как изглежда движението на молекулите в идеален газ.
Газът може да се счита за идеален, ако в него са изпълнени следните предположения:
- Потенциалната енергия на взаимодействие на молекулите на идеалния газ е толкова малка, че се пренебрегва в сравнение с кинетичната енергия.
- Молекулите в идеалния газ също са толкова малки, че могат да се считат за материални точки. Това означава, че техните общ обем също е незначително в сравнение с обема на съда, в който се намира газът. И този обем също се пренебрегва.
- Средното време между сблъсъците на молекули е много по-дълго от времето на взаимодействието им по време на сблъсъка. Следователно времето за взаимодействие също се пренебрегва.
Газът винаги приема формата на съда, в който се намира. Подвижните частици се сблъскват помежду си и със стените на съда. По време на удара всяка молекула действа върху стената с известна сила за много кратък период от време. Ето как натиск. Общото налягане на газа е сбор от наляганията на всички молекули.
Идеално уравнение на състоянието на газа
Състоянието на идеалния газ се характеризира с три параметъра: натиск, сила на звука и температура. Връзката между тях се описва от уравнението:
R - универсална газова константа,
т - абсолютна температура (градуса по Келвин).
Където м - газова маса, М - моларна маса. Това уравнение се нарича от уравнението на Менделеев-Клиперон.
При постоянна маса уравнението приема формата:
Това уравнение се нарича единен закон за газа.
Използвайки закона на Менделеев-Клиперон, един от газовите параметри може да бъде определен, ако другите два са известни.
Изопроцеси
Използвайки уравнението на единния закон за газа, е възможно да се изследват процеси, при които масата на газа и един от най-важните параметри - налягане, температура или обем - остават постоянни. Във физиката такива процеси се наричат изопроцеси.
Други важни газови закони произтичат от единния закон за газа: Закон на Бойл-Мариот, гей-лусак закон, Законът на Чарлз или вторият закон на Гей-Люсак.
Изотермичен процес

Извиква се процесът, при който налягането или обемът се променят, но температурата остава постоянна изотермичен процес.
С изотермичен процес T = const, m = const.
Описано е поведението на газ в изотермичен процес Закон на Бойл-Мариот. Този закон беше открит експериментално от английския физик Робърт Бойл през 1662 г. и френския физик Едм Мариот през 1679 г. И те го направиха независимо един от друг. Законът на Бойл е формулиран по следния начин: В идеалния газ с постоянна температура произведението на налягането и обема на газа също е постоянно.
Уравнението на Boyle-Mariotte може да бъде получено от единния закон за газа. Заместване във формулата T = const , получаваме
Това е Закон на Бойл-Мариот. Формулата показва това налягането на газа при постоянна температура е обратно пропорционално на неговия обем. Колкото по-високо е налягането, толкова по-малък е обемът и обратно.
Как да обясня това явление? Защо с увеличаване на обема на газа налягането му става по-малко?
Тъй като температурата на газа не се променя, честотата на въздействието на молекулите върху стените на съда също не се променя. Ако обемът се увеличи, тогава концентрацията на молекулите става по-малка. Следователно има по-малко молекули на единица площ, които се сблъскват със стените за единица време. Налягането спада. Напротив, с намаляване на обема, броят на сблъсъците се увеличава. Съответно се увеличава и налягането.
Изотермичният процес се показва графично на равнината на кривата, която се нарича изотерма. Има формата хипербола.
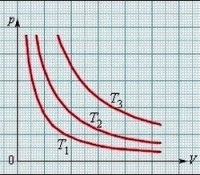
Всяка температурна стойност има своя собствена изотерма. Колкото по-висока е температурата, толкова по-висока е съответната изотерма.
Изобарен процес
Извикват се процесите на промяна на температурата и обема на газа при постоянно налягане изобарен. За този процес m = const, P = const.
Кога P = конст уравнението на единния закон за газа става Уравнение на Гей-Люсак.
Пример за изобарен процес е газът в цилиндър, в който се движи бутало. С повишаване на температурата честотата на сблъсъците на молекули срещу стените се увеличава. Налягането се натрупва и буталото се повишава. В резултат на това обемът, зает от газа в цилиндъра, се увеличава.
Графично изобарният процес се показва като права линия, която се нарича изобарен.
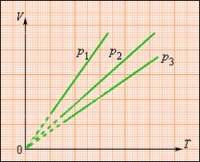
Колкото по-високо е налягането в газа, толкова по-ниска е съответната изобара на графиката.
Изохорен процес

Изохорни, или изохорен, е процесът на промяна на налягането и температурата на идеален газ при постоянен обем.
За изохорен процес m = const, V = const.
Много е просто да си представим такъв процес. Провежда се в съд с фиксиран обем. Например в цилиндър, в който буталото не се движи, а е твърдо фиксирано.
Описан е изохорният процес Закон на Чарлз: "За дадена маса газ с постоянен обем налягането му е пропорционално на температурата". Френският изобретател и учен Жак Александър Сезар Шарл установява тази връзка с помощта на експерименти през 1787 г. През 1802 г. Гей-Люсак я изяснява. Следователно този закон понякога се нарича вторият закон на Гей-Люсак.
Кога V = конст от уравнението на закона за комбинирания газ получаваме уравнението Закон на Чарлз, или Вторият закон на Гей-Люсак.
При постоянен обем налягането на газа се увеличава, ако температурата му се повиши .
На графиките изохорният процес се показва чрез линия, наречена изохора.
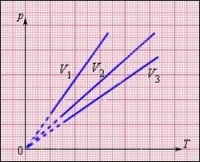
Колкото по-голям е обемът, зает от газа, толкова по-нисък е изохорът, съответстващ на този обем.
В действителност нито един параметър на газа не може да се поддържа постоянен. Това може да се направи само при лабораторни условия.
Разбира се, в природата няма идеален газ. Но при истински разредени газове при много ниски температури и налягания не по-високи от 200 атмосфери разстоянието между молекулите е много по-голямо от техния размер. Следователно техните свойства се доближават до тези на идеалния газ.
- Идеална индуктивност със синусоидален ток
- Идеално еластично тяло - Голяма енциклопедия на нефт и газ, статия, страница 1
- Идеалното оръжие като "дава огън" автомат Калашников
- Идеалното твърдение за проблема - какво е това
- Перфектно домашно облъчване